Veterinaria (Montevideo), 2025 61, (224), 10.29155/VET.61.224.7
Artículo original
Aborto en ganado de carne en Uruguay: evaluación de leptospirosis y otros agentes infecciosos
Abortion in beef cattle in Uruguay: evaluation of leptospirosis and other infectious agents
Aborto em bovinos de corte no Uruguai: avaliação da leptospirose e de outros agentes infecciosos
Valentina Macchi1 https://orcid.org/0000-0002-1836-852X
Alejandra Suanes1 https://orcid.org/0000-0002-1513-7734
Ximena Salaberry1 https://orcid.org/0000-0002-9410-2176
Bruno Dearmas1 https://orcid.org/0009-0004-5828-4680
Emiliano Rivas1 https://orcid.org/0009-0008-4720-7742
Andrés Gil2 https://orcid.org/0000-0003-0006-5640
1 Dirección de Laboratorios Veterinarios (DILAVE), Ministerio de Ganadería, Agricultura y Pesca, Montevideo, Uruguay. Autor para correspondencia: mmacchi@mgap.gub.uy
2 Universidad Tecnológica, Montevideo, Uruguay.
La leptospirosis es una reconocida zoonosis bacteriana causada por Leptospira spp. En bovinos, su ocurrencia suele estar más vinculada a afecciones reproductivas. Este estudio pretende determinar la asociación del aborto con la seropositividad de cepas locales y los niveles de excreción por orina de Leptospiras patógenas en vacas para producción de carne no vacunadas en Uruguay. Se llevó a cabo un estudio de casos y controles en 31 predios ganaderos sin antecedentes de vacunación contra leptospirosis de al menos un año. En cada predio, se realizó el seguimiento a 25 vacas preñadas de menos de tres meses de gestación. Se realizaron tres visitas a lo largo de la gestación de las vacas: dentro del primer tercio de gestación, dentro del segundo tercio de gestación y otra posparto. Se identificaron en cada visita las vacas abortadas, colectando muestras de sangre y orina a estas vacas y a dos compañeras por cada abortada. Se realizó diagnóstico serológico para Leptospira spp. (test de microaglutinación), rinotraqueítis infecciosa bovina, diarrea viral bovina y Neospora caninum (ELISA). Con las muestras de orina se hizo qPCR para la detección de Leptospiras patógenas. Se realizó una regresión logística teniendo en cuenta al predio como variable aleatoria. El análisis incluyó 35 vacas abortadas y 61 vacas controles. Las vacas abortadas tenían 8,06 veces más chance de ser seropositivas al serogrupo Pomona con respecto a vacas preñadas o que habían paridos un ternero a término (p = 0,01). Hubo una fuerte asociación con la seropositividad a Neospora caninum, las vacas abortadas tenían 11,31 veces más chance de ser seropositivas a este protozoario con respecto al grupo control (p < 0,01). Si bien se establece asociación entre la leptospirosis y el aborto en vacas de carne, se deberían realizar estudios más dirigidos para establecer con mayor precisión el impacto de esta enfermedad en sistemas ganaderos.
Palabras clave: Perdidas reproductivas, Ganadería, Leptospirosis bovina.
Keywords: Reproductive losses, Cattle farming, Bovine leptospirosis.
Resumo
A leptospirose é uma zoonose bacteriana bem reconhecida, causada por Leptospira spp. Em bovinos, sua ocorrência está frequentemente associada a distúrbios reprodutivos. Este estudo tem como objetivo determinar a associação entre aborto, soropositividade para cepas locais e níveis de excreção urinária de Leptospira patogênicas em vacas de corte não vacinadas no Uruguai. Foi realizado um estudo de caso-controle em 31 fazendas sem histórico de vacinação contra leptospirose por pelo menos um ano. Em cada fazenda, foram monitoradas 25 vacas prenhes com menos de três meses de gestação. Foram realizadas três visitas ao longo da gestação das vacas: no primeiro terço, no segundo terço e no período pós-parto. Em cada visita, as vacas que abortaram foram identificadas, e amostras de sangue e urina foram coletadas dessas vacas e de duas companheiras para cada uma que abortou. O diagnóstico sorológico foi realizado para Leptospira spp. (teste de microaglutinação), rinotraqueíte infecciosa bovina, diarreia viral bovina e Neospora caninum (ELISA). As amostras de urina foram analisadas por qPCR para a detecção de Leptospira patogênicas. Foi realizada uma regressão logística, considerando a fazenda como uma variável aleatória. A análise incluiu 35 vacas que abortaram e 61 vacas controles. As vacas que abortaram tiveram 8,06 vezes mais chances de serem soropositivas para o sorogrupo Pomona em comparação com vacas prenhes ou que pariram um bezerro a termo (p = 0,01). Além disso, foi observada uma forte associação com a soropositividade para Neospora caninum, sendo que vacas que abortaram tiveram 11,31 vezes mais chances de serem soropositivas para esse protozoário em comparação com o grupo controle (p < 0,01). Embora tenha sido estabelecida uma associação entre leptospirose e aborto em vacas de corte, estudos mais direcionados devem ser realizados para determinar com maior precisão o impacto dessa doença nos sistemas pecuários.
Palavras-chave: Perdas reprodutivas, Pecuária, Leptospirose bovina.
Fecha de recibido: 17/02/2025
Fecha de aceptado: 01/10/2025
Introducción
Uruguay es reconocido por su industria ganadera, con más de 11 millones de bovinos en su territorio. En el año 2023, alcanzó a exportar en torno a 1 millón de toneladas de carne y 90 mil cabezas de ganado al pie (Ministerio de Ganadería Agricultura y Pesca, 2023). Estos niveles de producción están directamente relacionados con los índices productivos y reproductivos en los predios ganaderos, por lo que es importante promover su mejora continua. Las enfermedades abortivas en bovinos son una de las causas más reconocidas por afectar estos indicadores, aunque es sabido que se encuentran subdiagnosticadas (Mee, 2023).
El aborto es una de las afecciones reproductivas más importantes en el ganado bovino y suele ser multifactorial, con diversas causas infecciosas que incluyen agentes bacterianos, virales, protozoarios y fúngicos (Givens & Marley, 2008; Reichel et al., 2018). Entre las causas más destacadas a nivel mundial se encuentran Brucella abortus, Neospora caninum, Leptospira spp., el virus de la diarrea viral bovina y rinotraqueítis infecciosa bovina (herpesvirus bovino tipo 1). Estas enfermedades pueden provocar abortos en diferentes etapas de la gestación y están asociadas con una serie de complicaciones reproductivas (Givens & Marley, 2008).
La leptospirosis es reconocida por producir diferentes afecciones reproductivas en bovinos, el aborto es la más reportada a nivel mundial (Adler et al., 2011). La ocurrencia de aborto puede darse principalmente de dos formas, según qué serovar sea el infectivo. La leptospirosis bovina incidental es ocasionada por serovares no adaptados al huésped, como por ejemplo Pomona, en este caso el aborto se desarrolla principalmente en el último tercio de gestación, y en rodeos puede ocurrir como tormenta de aborto. La leptospirosis bovina adaptada se da cuando el bovino se infecta por serovares adaptados al huésped, como es el caso del serovar Hardjo bovis, en el que la infección será del tipo crónica y asintomática, y es más probable la ocurrencia de infertilidad y reabsorciones embrionarias. En este último caso, los abortos son menos frecuentes y se dan a partir del cuarto mes de gestación (Loureiro & Lilenbaum, 2020).
Tanto a nivel mundial como en Latinoamérica, existen múltiples investigaciones que han estudiado cómo se asocia el aborto en bovinos con la leptospirosis, los resultados reportados varían si se trata de serovares adaptados o no adaptados (Sohm et al., 2023). En el primer caso, la discusión es muy controvertida, ya que algunos estudios no mostraron una asociación entre la seropositividad a este patógeno y el aborto (Carter et al. 1982; Chappel et al., 1989; Dixon, 1983; Elder et al., 1985), en contraste con otros que sí la asociaron (Ellis et al., 1985; Ellis, 1986). Por otro lado, en el caso de los serovares no adaptados a los bovinos, sí se han reportado casos claros de tormenta de abortos (Givens, 2006; Murillo et al., 2024; Varni et al., 2016). A nivel local, si bien se han realizado estudios observacionales en los que se reporta la seroprevalencia tanto en ganado lechero como carnicero (Repiso et al., 2005; Suanes et al., 2024), hoy en día no hay datos que relacionen la leptospirosis con el aborto en ganado bovino.
En Uruguay, se han identificado varias cepas circulantes en rodeos bovinos, incluyendo L. interrogans serogrupo Pomona, L. borgpetersenii serogrupo Sejroe, L. noguchii serogrupo Autumnalis, L. noguchii serogrupo Australis, L. noguchii serogrupo Pyrogenes, L. interrogans serogrupo Canicola y dos cepas sin identificación de serogrupo de L. noguchii (Zarantonelli et al., 2018). Si bien se sabe que estas cepas están circulando, y se ha estudiado su prevalencia en rodeos lecheros (Suanes et al., 2024), se desconoce el impacto que tienen en la ocurrencia de aborto en ganado de carne. Es por eso que el objetivo de este trabajo fue determinar la asociación del aborto con la seropositividad de cepas locales y los niveles de excreción por orina de Leptospiras patógenas en vacas para producción de carne no vacunadas en Uruguay.
La manipulación de todos los animales utilizados para este trabajo cuenta con la aprobación de la Comisión de Ética en el Uso de Animales (CEUA CHEA N.o 88095) perteneciente a la DILAVE - DGSG - MGAP.
Diseño del estudio
Se realizó un estudio del tipo casos y controles anidado en un estudio de cohorte para evaluar la asociación entre leptospirosis, neosporosis e infecciones virales y la ocurrencia de aborto en vacas de carne. Los predios fueron seleccionados en conjunto con 13 veterinarios de libre ejercicio. Se seleccionaron un total de 31 predios ganaderos, utilizando un muestreo por conveniencia, que debían cumplir las siguientes condiciones: sin antecedentes de vacunación contra leptospirosis de al menos un año, el uso de ultrasonografía para el diagnóstico de gestación y el mantenimiento de registros de información confiables. El período de servicio en estos predios se realizaba durante tres meses aproximadamente, desde diciembre hasta febrero, aplicando tanto el servicio con toro como inseminación artificial. Todo el ganado es obligatoriamente vacunado cada año contra la fiebre aftosa en febrero y mayo. Estos predios tampoco tenían historial de vacunación ni antecedentes diagnosticados de otras enfermedades reproductivas y estaban compuestos predominantemente por ganado hereford o angus. El muestreo se realizó durante los meses de marzo y abril de 2020 a 2022 en diez de los 19 departamentos del Uruguay.
Para la definición del número de animales a muestrear por predio, se tomó como referencia información reportada por Zarantonelli et al. (2018), quienes estimaron una prevalencia de excreción urinaria de Leptospira spp. del 20 % a nivel individual. Bajo este supuesto, se estimó que era necesario muestrear al menos 14 animales por predio para asegurar una probabilidad del 95 % de detectar al menos un animal positivo en un predio infectado. Por otro lado, con el número de animales finalmente muestreados por predio (25 vacas), la probabilidad de observar al menos un aborto, asumiendo una tasa mínima de aborto del 5 %, fue del 72 %. En cuanto al número de predios incluidos, estos fueron seleccionados por conveniencia, en función de las limitaciones presupuestales del proyecto y la disponibilidad de establecimientos que cumplieran con los criterios previamente establecidos.
En cada predio, los veterinarios de libre ejercicio realizaban la ecografía para el diagnóstico de gestación. Se seleccionaban aleatoriamente 25 vacas que estuvieran en el primer tercio de su gestación. Estas vacas eran identificadas individualmente y se les realizaban un total de tres muestreos: al momento de la ecografía (T1), durante el segundo tercio de gestación (T2) y luego de parida (T3). En el muestreo T2 se verificó la continuidad de la gestación mediante ecografía o tacto rectal, mientras que en el muestreo T3 se registró la presencia de ternero al pie. En todos los muestreos se tomaron muestras de sangre y orina a cada vaca.
Se definió como caso toda vaca que hubiera abortado, es decir, aquellas vacías en T2 o que no hubieran parido en T3. En T1, si durante la visita se detectaba una vaca abortada, está también se incluía como caso. Por cada caso, se seleccionaron dos controles, dos vacas preñadas en ese mismo muestreo. Las vacas controles no se repetían en los diferentes muestreos: si una de ellas abortaba posteriormente, pasaba a considerarse caso y se excluía del grupo control. Asimismo, si una vaca control no estaba disponible para la verificación de la gestación en el muestreo siguiente, se eliminaba del grupo. Las muestras utilizadas para cada diagnóstico correspondieron a las tomadas en el muestreo en que se constataba el aborto.
Toma de muestras y análisis de laboratorio
Se colectaron muestras de sangre mediante venopunción de la vena coccígea en tubos sin anticoagulante y se transportaron refrigeradas. Los sueros fueron luego almacenados a -20 °C. Previo a la extracción de orina, cada vaca recibió administración intramuscular de diuréticos (~150 mg de furosemida, Furo R, Ripoll) y se le realizó una limpieza exhaustiva de los órganos genitales (limpieza con etanol al 70 % y algodón). Se recolectaron aproximadamente 60 mL de orina correspondiente a la porción media de la micción espontánea inducida por masaje perineal, evitando el primer chorro para reducir el riesgo de contaminación. Dicha colección se realizó en recipientes estériles de 120 mL y se transportaron a 4 °C al laboratorio junto con las muestras correspondientes de sangre/suero.
Las muestras de suero se emplearon para evaluar los títulos de anticuerpos anti-Leptospira utilizando la Prueba de Aglutinación Microscópica (MAT, por sus siglas en inglés), siguiendo protocolos establecidos (Faine et al., 1999). El punto de corte para determinar una muestra como positiva fue de 1:100. El panel de antígenos utilizado consistió en cepas locales de los serogrupos Sejroe, Pomona, Autumnalis, Australis, Pyrogenes y Canicola; además de dos cepas locales no identificadas de la especie noguchii (Zarantonelli et al., 2018). Para este último caso, una muestra era considerada como positiva para L. noguchii si mostraba reactividad con al menos una de las cepas.
La amplificación por reacción en cadena de la polimerasa cuantitativa (qPCR) de lipL32 se realizó utilizando ADN purificado extraído de 10 mL de muestras de orina bovina, siguiendo los protocolos establecidos por Nieves (2018). La amplificación de PCR de LipL32 se logró utilizando los primers lipL32-188F (5'- TAAAGCCAGGACAAGCGCC-3') y lipL32-270R (5'-TACGAACTCCCATTTCAGCG-3'). La qPCR se realizó en 10 μL de FastSart Universal SYBER Green Master, 0,20 μg/μL de albúmina sérica bovina (Sigma), 0,2 μL de primers para control endógeno (fragmento de gen gBlock - 1000 copias/μL), 5,8 μL de H2O libre de DNAsa/RNAsa y 2 μL de ADN molde. El ciclado de PCR incluyó 1 ciclo de desnaturalización (10 min a 95 °C), 40 ciclos de amplificación (cada ciclo 30 s a 95 °C y 30 s a 60 °C) y un ciclo final para la curva de melting (15 s a 95 °C, 15 s a 60 °C y 15 s a 95 °C). El límite de detección de qPCR (diez copias de Leptospiras) se adoptó del protocolo descrito por Nieves Álvarez (2018). Una vez obtenidos los datos de cuantificación, se ajustaron para normalizar el número de Leptospiras a 1 mL de orina. Estos ajustes tuvieron en cuenta el volumen de elución (100 μL), el volumen de orina utilizado para la extracción (10 ml) y el volumen de ADN usado en la reacción de PCR (2 μL).
Se llevó a cabo la evaluación de anticuerpos contra el virus de la diarrea viral bovina (DVB), la rinotraqueítis infecciosa bovina (IBR) y Neospora caninum para ser considerados en el proceso de modelado, dada su asociación reportada con el aborto en el ganado. Para la detección de anticuerpos contra DVB, se empleó un kit comercial de ELISA competitivo dirigido a los anticuerpos p80-125 (anti-NSP2-3) (ID Vet, Grabels, Francia). Con respecto a IBR, se utilizó un kit de ELISA indirecto (ID Vet, Grabels, Francia) para detectar anticuerpos anti-BHV-1. Para la detección de anticuerpos contra Neospora caninum se utilizó un kit comercial de ELISA indirecto (ID Vet, Grabels, Francia). Los tres kits utilizados se ejecutaron estrictamente de acuerdo con los protocolos proporcionados por el fabricante. A todas las muestras se les realizó la técnica de Rosa de Bengala para el diagnóstico de brucelosis bovina.
En Uruguay se ha implementado un sistema legislado de trazabilidad individual que abarca a todo el ganado mediante caravanas electrónicas en las orejas. Este sistema garantiza la disponibilidad de información detallada para cada vaca. Por lo tanto, se documentó la edad de cada vaca.
Análisis estadístico
Se realizó un modelo de regresión logística de efectos mixtos para análisis multivariable utilizando STATA/IC 2015 (StataCorp, 2017; Stata Statistical Software: Release 15; College Station, TX: StataCorp LLC). La variable dependiente se categorizó como vacas preñadas o abortadas, mientras que la variable “predio” se trató como una variable de estrato (efecto aleatorio). Todos los análisis se llevaron a cabo a nivel individual de la vaca. Para variables independientes continuas, se evaluó la linealidad con la variable de respuesta. En casos donde se identificó evidencia discernible de no linealidad, las variables independientes se categorizaron apropiadamente.
El análisis univariado se utilizó para evaluar la fuerza de la asociación entre la variable dependiente y las variables independientes. Las variables independientes consideradas para el análisis fueron seropositividad a cada serogrupo de Leptospira (punto de corte 1/100); seropositividad a cada serogrupo de Leptospira (punto de corte 1/100) del muestreo anterior a la ocurrencia de aborto; qPCR; seropositividad a IBR, BVDV y Neospora caninum, y la edad de las vacas. Las covariables que mostraron valores de p ≤ 0,2 en la prueba de chi-cuadrado se consideraron para su posible inclusión en el modelo multivariado. Se evaluó la colinealidad entre variables utilizando el coeficiente de correlación de Spearman. Si dos variables mostraban un coeficiente de correlación mayor de 0,7, se conservaba la variable más fuertemente relacionada con el resultado para un análisis posterior.
El modelo de regresión logística multivariado final se construyó manualmente utilizando el método forward. Las variables se añadieron al modelo en función de la significancia de los valores de p derivados de la prueba de Wald ajustada (p ≤ 0,5). La significancia del modelo completo se determinó utilizando el Criterio de Información de Akaike (AIC, por sus siglas en inglés).
Además, se examinaron términos de interacción entre variables independientes con plausibilidad biológica. Para este propósito, se calcularon las odds ratio (OR) de Mantel-Haenszel para realizar la prueba de homogeneidad. Las interacciones se evaluaron en casos donde el valor de p era menor que 0,05. Se investigaron posibles efectos de confusión, monitorizando alteraciones en las estimaciones de las variables retenidas en el modelo. Cambios en las estimaciones de parámetros superiores al 20 % se consideraron indicativos de confusión y se mantuvieron en el modelo.
Se colectaron muestras de un total de 96 vacas de carne, pertenecientes a 18 de los 31 predios seleccionados inicialmente; los 13 predios restantes fueron excluidos al no registrarse abortos durante el período de estudio. De las 96 vacas, 35 fueron clasificadas como casos (abortadas) y 61 como controles (preñadas) (tabla 1), esta diferencia se debe a que nueve controles debieron ser descartados por ausencia en el muestreo siguiente o por detectarse aborto posteriormente. Cada uno de los predios tuvieron una mínima de 1 y una máxima de 7 abortos en las vacas seleccionadas, la descripción de cantidad de abortos por predio se encuentra representada en la figura 1. Todas las muestras resultaron negativas a la prueba de Rosa de Bengala.
Tabla 1. Distribución de vacas abortadas (casos) y preñadas (controles) de acuerdo al momento de gestación en predio ganaderos

Figura 1: Distribución del número de abortos en predios ganaderos con al menos un aborto detectado durante el período 2020-2022

En el análisis univariado 5 variables tuvieron una p < 0,2 (tabla 2), por lo que fueron tenidas en cuenta para el análisis multivariado. La serología del muestreo anterior no tuvo asociación con la ocurrencia de aborto. Las dos variables continuas evaluadas (edad de las vacas y qPCR) no demostraron evidencia de linealidad con respecto a la variable de respuesta, por lo que fueron adecuadamente categorizadas (tabla 2). No se encontraron indicios de correlación entre variables independientes.
Tabla 2. Análisis univariado de variables independientes asociadas con aborto en vacas de carne de Uruguay

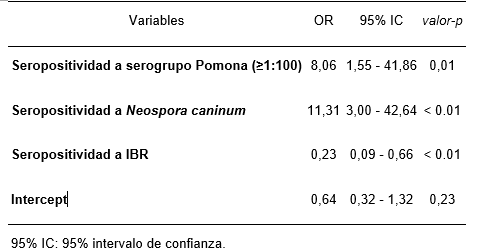
En el análisis multivariado tres variables conformaron el modelo final (tabla 3). Vacas abortadas presentaron odds 8,06 veces mayores de ser seropositivas al serogrupo Pomona, en comparación con vacas preñadas o que parieron un ternero a término. Por otro lado, se observó una fuerte asociación con la seropositividad a Neospora caninum: las vacas abortadas presentaron odds 11,31 veces mayores de ser seropositivas a este protozoario en comparación con el grupo control. Al evaluar posibles variables confusoras, se encontró que la inclusión de la variable seropositividad a IBR actuaba como un potencial factor de confusión en la asociación con la seropositividad al serogrupo Pomona. Las odds de seropositividad a Pomona aumentaban un 52 % al incluir esta variable, pasando de 5,29 a 8,06, por lo que se decidió mantenerla en el modelo final.
Tabla 3. Modelo de regresión logística de efectos mixtos, con variable predio como efecto aleatorio, para evaluar asociación de variables independientes con ocurrencia de abortos en vacas de carne en Uruguay
El aborto es una problemática reconocida en el sector agropecuario por su impacto tanto reproductivo como productivo. Sin embargo, su detección en los sistemas de cría bovina, que en Uruguay suelen ser extensivos, no siempre resulta sencilla. Se estima que existe un subregistro en su ocurrencia y, cuando se detecta, la identificación de la causa se ve dificultada por su etiología multifactorial. En bovinos, se define como aborto la muerte fetal o placentaria a partir del día 42 de gestación o bien la expulsión del feto antes del umbral de viabilidad (menor a 260 días). No obstante, estos límites pueden ser discutibles, ya que la viabilidad del ternero puede ser arbitraria (Mee, 2023). A esto se suma la dificultad de no conocer con exactitud el momento en que ocurrió el aborto, lo que impide relacionarlo temporalmente con posibles causas. En este contexto, los estudios longitudinales para investigar el aborto en bovinos presentan importantes desafíos, ya que su éxito depende de contar con una frecuencia suficiente de eventos durante el período de observación, lo cual resulta difícil de prever. Pese a estas limitaciones, en el presente estudio se logró hacer un seguimiento longitudinal de vacas gestantes en establecimientos extensivos, lo que permitió identificar eventos de aborto con un intervalo estimado de ocurrencia de hasta tres meses y explorar su posible asociación con agentes infecciosos.
La ocurrencia de aborto en bovinos causado por infecciones por Leptospira varía de acuerdo a si el serovar infectante es del tipo incidental o adaptado. En los casos de las infecciones de serovares adaptados a los bovinos, como son el caso de Hardjo bovis, el aborto suele darse de forma poco frecuente en los rebaños y puede ocurrir de 6 a 12 semanas posinfección. Por otro lado, si las infecciones son del tipo incidentales, como ocurre con el serovar Pomona, por ejemplo, el aborto ocurre más frecuentemente en los rebaños y suele darse de 4 a 6 semanas posinfección (Adler & de la Peña Moctezuma, 2010).
Si bien el MAT es ampliamente utilizado y se considera una herramienta muy útil para el diagnóstico a nivel de rodeo, su interpretación a nivel individual es limitada, especialmente en casos de infecciones crónicas, en las que suele recomendarse el uso de métodos directos (Hernández-Rodríguez et al., 2011). Actualmente, en Uruguay, el MAT continúa siendo la herramienta más accesible con la que cuentan los veterinarios para realizar un diagnóstico en el predio, por lo que resulta relevante evaluar su asociación con indicadores reproductivos. Un aspecto clave en este estudio fue la selección de predios sin antecedentes de vacunación contra leptospirosis, dado que el MAT no permite diferenciar entre anticuerpos inducidos por vacunas comerciales y aquellos generados por infecciones naturales, lo cual puede generar reacciones cruzadas entre serogrupos y dificultar la interpretación de los resultados (Hamond et al., 2014; Musso & La Scola, 2013; Organización Mundial de Sanidad Animal, 2021; Pinto et al., 2017). Esta precaución fue indispensable para asegurar la validez de los resultados serológicos obtenidos.
El serogrupo Sejroe fue el más prevalente en este trabajo, seguido por el serogrupo Pomona. Esto coincide con lo reportado en el último estudio de seroprevalencia a nivel nacional (Suanes et al., 2024) y con reportes de Latinoamérica (Pinto et al., 2017). Fávero et al. (2017) también encontraron estos serogrupos como más prevalentes en el sur de Brasil y lograron asociarlos con afecciones reproductivas, determinaron que las vacas con problemas reproductivos presentaban odds ocho veces mayores de ser seropositivas a Leptospira.
Si bien se ha reportado que el serogrupo Sejroe es causante de abortos en bovinos, estas cepas de Leptospira se encuentran adaptadas a los bovinos y causan abortos de forma esporádica (Grooms, 2006). Hardjo bovis es reconocida por circular en los rodeos de forma endémica en Uruguay (Suanes et al., 2024), lo que dificulta la observación de abortos asociados a este serovar. Esto concuerda con la ausencia de asociación encontrada entre niveles de excreción en orina y la ocurrencia de aborto, ya que la eliminación urinaria se vincula principalmente a infecciones crónicas causadas por cepas adaptadas (Adler et al., 2015), en las que predominan afecciones reproductivas como la infertilidad y las pérdidas embrionarias tempranas (Macchi et al., 2024). En este marco, en Brasil se ha explorado la PCR en fluidos vaginales como herramienta diagnóstica. Si bien estas herramientas moleculares pueden aportar información adicional a la serología, sus resultados deben ser interpretados con cautela, dado que la detección de Leptospira en el aparato reproductor se ha asociado sobre todo a infecciones crónicas, más relacionadas con infertilidad y pérdidas embrionarias tempranas que con abortos clínicamente evidentes (Loureiro & Lilenbaum, 2020).
No se encontró asociación con el aborto y las cepas locales aisladas por Zarantonelli et al. (2018). Como se observa la seroprevalencia de estas cepas fue muy baja, tal como lo reporta Suanes et al. (2024) en el ganado lechero. No está claro el efecto que tienen estas cepas en bovinos, los bajos niveles de seropositividad podrían deberse a la baja circulación de estas cepas o al bajo nivel de patogenicidad que tiene sobre los bovinos. Se deberían realizar estudios más dirigidos para evaluar el impacto que tienen en los índices reproductivos en bovinos.
Si bien el foco principal del estudio fue evaluar la asociación entre leptospirosis y los abortos, se consideró fundamental incluir otras enfermedades infecciosas relevantes, tales como IBR, DVB y Neospora caninum, para ajustar adecuadamente el modelo y evitar asociaciones espurias. Tanto IBR como DVB han sido reportados como causas de aborto en bovinos (Anderson, 2007; Grooms, 2006). En el caso del virus de DVB, los niveles de seropositividad fueron muy elevados en ambos grupos analizados, lo que impidió observar una asociación clara con la ocurrencia de aborto. Por otra parte, la variable correspondiente al virus de IBR se mantuvo en el modelo principalmente por su rol como variable confusora, particularmente en relación con el serogrupo Pomona. A pesar de que la razón de odds observada para IBR fue relativamente baja (OR < 1), resulta llamativo dada su reconocida implicancia en afecciones reproductivas (Mahmoud et al., 2009; Nettleton & Russell, 2017). Si bien se ha documentado que la persistencia de anticuerpos frente a infecciones virales puede conferir protección frente a nuevas infecciones, esto explicaría parcialmente el menor riesgo en animales seropositivos, pero no se identificó una explicación clara para el mayor riesgo observado en animales seronegativos al punto de corte comercial.
A nivel internacional, Neospora caninum es reconocida como una de las causas infecciosas más frecuentes de aborto bovino, lo que genera importantes pérdidas económicas en los sistemas de producción (Reichel et al., 2013), y su control continúa siendo un desafío (Mee, 2023). En Uruguay, la neosporosis bovina se considera endémica en el rodeo. Los últimos estudios de seroprevalencia estimaron una prevalencia individual del 14 % en ganado de carne (Bañales et al., 2006) y del 22,3 % en ganado lechero (Macchi et al., 2020). En ambos casos se reportó una elevada prevalencia a nivel predial, de 69,2 % y 96 %, respectivamente, lo que evidencia la amplia difusión de este parásito en el país. Dada la epidemiología de la enfermedad, se espera que la mayoría de los abortos ocurran de manera esporádica, asociados principalmente a la transmisión endógena (Dubey et al., 2006). Sin embargo, también se han descrito brotes epidémicos cuando más del 10 % de las vacas gestantes abortan en un período de 6 a 8 semanas, lo que refleja la capacidad de N. caninum de causar tanto pérdidas aisladas como eventos de gran magnitud. Asimismo, se ha demostrado que las vacas seropositivas tienen mayor probabilidad de abortar que las seronegativas, con incrementos de títulos de anticuerpos meses antes del parto, lo que sugiere reactivación de infecciones latentes durante la gestación (Lindsay & Dubey, 2020).
En relación con el aborto, estudios recientes en Uruguay han confirmado la importancia de N. caninum como agente causal (Macías-Rioseco et al., 2020; Briano et al., 2021). En 2020, se llevó a cabo un estudio en 102 casos de aborto en vacas de leche en el país y se observó que la principal causa de aborto era Neospora caninum (29 %), seguido de Coxiella burnetti (6 %) y Campilobacter fetus subsp. venerealis (2 %) (Macías-Rioseco et al., 2020). Los hallazgos reportados en el presente trabajo coinciden con esta tendencia: si bien no se puede establecer casualidad con los datos presentados, la asociación observada constituye un fuerte indicador del impacto de la enfermedad en los rodeos. Además, se observó una mayor proporción de abortos en el T2, lo cual coincide con la epidemiología de la infección y con la hipótesis de reactivación endógena. Este aspecto podría reflejar un posible sesgo, ya que los predios incluidos no fueron seleccionados al azar, sino que podrían haber tenido antecedentes de problemas reproductivos no observados compatibles con neosporosis. De todas maneras, la asociación encontrada resulta relevante y refuerza la necesidad de considerar sistemáticamente a la neosporosis dentro del diagnóstico diferencial de abortos bovinos. La evidencia internacional también sugiere que la infección no solo provoca abortos clínicamente evidentes, sino que compromete la eficiencia reproductiva global del rodeo, lo que subraya su impacto sanitario y económico (Lindsay & Dubey, 2020).
Diversos estudios han asociado la edad de los animales con una mayor seropositividad frente al serogrupo Sejroe, en ellos se observaron niveles más altos de anticuerpos a medida que aumenta la edad (Desa et al., 2021). La relación entre edad (particularmente expresada como número de partos o paridad) y aborto ha sido ampliamente discutida en la literatura, especialmente en el contexto de sistemas lecheros, aunque los resultados son dispares y no existe un consenso claro al respecto (Mee, 2023). Esta falta de uniformidad podría explicarse por el hecho de que la edad, por sí sola, no actuaría como un factor de riesgo directo para el aborto, sino más bien como una variable que modula la susceptibilidad a distintas etiologías reproductivas según el momento de vida del animal. Por tanto, interpretar una asociación simple entre edad y aborto puede resultar ambiguo. En este estudio, la inclusión de la edad en el modelo multivariado no modificó sustancialmente las razones de odds (OR) para las variables estudiadas, por lo que no fue considerada una variable confusora relevante de acuerdo a los datos obtenidos.
Este trabajo identificó como factores asociados al aborto en bovinos la seropositividad al serogrupo Pomona y a Neospora caninum. No se encontró evidencia de asociación entre el aborto y la seropositividad frente a las cepas locales de Leptospira previamente aisladas en el país. Este estudio contribuye con evidencia local que puede ser de utilidad en el diseño de estrategias de diagnóstico y prevención.
Agradecimientos
Al DILAVE-MGAP Paysandú, por su contribución en el muestreo en campo, en particular a los doctores Eduardo Gianneechini, Rodolfo Rivero y Víctor Rodríguez. A todos los veterinarios de práctica privada que obtuvieron los rodeos y colaboraron en la recolección de muestras —doctores José Luis Callero, Andrea Alves, Mauricio Alonso, Eduardo Lorenzelli, Florencia Correa, Agustín Saa, Victoria Ponz, Martín Martinicorena y Andrés Hiriart—. Al instituto Pasteur, en especial a Leticia Zarantonelli y Camila Ciuffo, por la colaboración en la puesta a punto de las técnicas moleculares. Este trabajo fue financiado por la Agencia Nacional de Investigación e Innovación (número de subvención FSSA_1_2018_1_152685).
Adler, B., Akira, S., Damaso, C., Galan, J. E., Garcia-Sastre, A., Lowen, A. C., Rappuoli, R., Rodrigues, M. L., & Weber, O. (2015). Leptospira and Leptospirosis. Springer. http://www.springer.com/series/82
Adler, B., & de la Peña Moctezuma, A. (2010). Leptospira and leptospirosis. Veterinary Microbiology, 140(3-4), 287-296. https://doi.org/10.1016/j.vetmic.2009.03.012
Adler, B., Lo, M., Seemann, T., & Murray, G. L. (2011). Pathogenesis of leptospirosis: The influence of genomics. Veterinary Microbiology, 153(1-2), 73-81. https://doi.org/10.1016/j.vetmic.2011.02.055
Anderson, M. L. (2007). Infectious causes of bovine abortion during mid-to late-gestation. Theriogenology, 68(3), 474-486. https://doi.org/10.1016/j.theriogenology.2007.04.001
Bañales, P., Fernandez, L., Repiso, M.V., Gil, A., Dargatz, D.A., & Osawa, T. (2006). A nationwide survey on seroprevalence of Neospora caninum infection in beef cattle in Uruguay. Veterinary Parasitology, 139(1), 15-20. https://doi.org/10.1016/j.vetpar.2006.03.004
Briano, C., Regidor-Cerrillo, J., Easton, C., Pieruccioni, F., Romero, A., Peraza, P., Mederos, A., & Dutra, F. (2021). Diagnóstico molecular de Neospora caninum en fetos abortados espontáneamente en bovinos de Uruguay. Veterinaria (Montevideo), 57(216), e20215721603. https://doi.org/10.29155/vet.57.216.3
Carter, M. E., Cordes, D. O., Holland, J. T. S., Lewis, S. F., & Lake, D. E. (1982). Leptospirosis: II. Investigation of clinical disease in dairy cattle in the Waikato district of New Zealand. New Zealand Veterinary Journal, 30(9), 136-140. https://doi.org/10.1080/00480169.1982.34915
Chappel, R. J., Millar, B. D., Adler, B., Hill, J., Jeffers, M. J., Jones, R. T., & Skilbeck, N. W. (1989). Leptospira interrogans serovar hardjo is not a major cause of bovine abortion in Victoria. Australian Veterinary Journal, 66(10), 330-333. https://doi.org/10.1111/j.1751-0813.1989.tb09719.x
Desa, G., Deneke, Y., Begna, F., & Tolosa, T. (2021). Seroprevalence and associated risk factors of Leptospira interrogans serogroup Sejroe Serovar Hardjo in dairy farms in and around Jimma Town, Southwestern Ethiopia. Veterinary Medicine International, 2021(1), 6061685. https://doi.org/10.1155/2021/6061685
Dixon, R. J. (1983). Leptospira interrogans serovar Hardjo: an abortifacient in New Zealand? A review of the literature. New Zealand Veterinary Journal, 31(7), 107-109. https://doi.org/10.1080/00480169.1983.34986
Dubey, J. P., Buxton, D., & Wouda, W. (2006). Pathogenesis of bovine neosporosis. Journal of Comparative Pathology, 134(4), 267-289. https://doi.org/10.1016/j.jcpa.2005.11.004
Elder, J. K., Pepper, P. M., Hill, M., & Ward, W. H. (1985). The significance of Leptospiral titres associated with bovine abortion. Australian Veterinary Journal, 62(8), 258-262. https://doi.org/10.1111/j.1751-0813.1985.tb14246.x
Ellis, W. A. (1986). The diagnosis of leptospirosis in farm animals. En W.A. Ellis & T.W.A Little (Eds.), The Present State of Leptospirosis. Diagnosis and Control (pp. 13-24). Martinus Nijhoff Publishers. https://op.europa.eu/en/publication-detail/-/publication/16f40837-964e-4ef1-a1b9-972c25c84d76/language-en
Ellis, W. A., O'brien, J. J., Cassells, J. A., Neill, S. D., & Hanna, J. (1985). Excretion of Leptospira interrogans serovar hardjo following calving or abortion. Research in Veterinary Science, 39(3), 296-298. https://doi.org/10.1016/s0034-5288(18)31717-x
Faine, S., Adler, B., Bolin, C., & Perolat, P. (1999). Leptospira and leptospirosis (2.a ed.). MediSci.
Fávero, J. F., de Araújo, H. L., Lilenbaum, W., Machado, G., Tonin, A. A., Baldissera, M. D., Stefani, L. M., & da Silva, A. S. (2017). Bovine leptospirosis: Prevalence, associated risk factors for infection and their cause-effect relation. Microbial Pathogenesis, 107, 149-154. https://doi.org/10.1016/j.micpath.2017.03.032
Givens, M. D. (2006). A clinical, evidence-based approach to infectious causes of infertility in beef cattle. Theriogenology, 66(3), 648-654. https://doi.org/10.1016/j.theriogenology.2006.04.021
Givens, M., & Marley, M. S. D. (2008). Infectious causes of embryonic and fetal mortality. Theriogenology, 70(3), 270–285. https://doi.org/10.1016/j.theriogenology.2008.04.018
Grooms, D. L. (2006). Reproductive losses caused by bovine viral diarrhea virus and leptospirosis. Theriogenology, 66(3), 624-628. https://doi.org/10.1016/j.theriogenology.2006.04.016
Hamond, C., Martins, G., Loureiro, A. P., Pestana, C., Lawson-Ferreira, R., Medeiros, M. A., & Lilenbaum, W. (2014). Urinary PCR as an increasingly useful tool for an accurate diagnosis of leptospirosis in livestock. Veterinary Research Communications, 38, 81-85. https://doi.org/10.1007/s11259-013-9582-x
Hernández-Rodríguez, P., Díaz, C. A., Dalmau, E. A., & Quintero, G. M. (2011). A comparison between polymerase chain reaction (PCR) and traditional techniques for the diagnosis of leptospirosis in bovines. Journal of Microbiological Methods, 84(1), 1-7. https://doi.org/10.1016/j.mimet.2010.10.021
Lindsay, D. S., & Dubey, J. P. (2020). Neosporosis, toxoplasmosis, and sarcocystosis in ruminants: an update. Veterinary Clinics of North America: Food Animal Practice, 36(1), 205-222. https://doi.org/10.1016/j.cvfa.2019.11.004
Loureiro, A. P., & Lilenbaum, W. (2020). Genital bovine leptospirosis: A new look for an old disease. Theriogenology, 141, 41-47. https://doi.org/10.1016/j.theriogenology.2019.09.011
Macchi, M. V., Suanes, A., Salaberry, X., Dearmas, B. E., Rivas, E., Piaggio, J., & Gil, A. D. (2024). Leptospirosis as a cause of infertility in Uruguayan beef cattle. Preventive Veterinary Medicine, 228, 106227. https://doi.org/10.1016/j.prevetmed.2024.106227
Macchi, M. V., Suanes, A., Salaberry, X., Fernandez, F., Piaggio, J., & Gil, A. D. (2020). Epidemiological study of neosporosis in Uruguayan dairy herds. Preventive Veterinary Medicine, 179, 105022. https://doi.org/10.1016/j.prevetmed.2020.105022
Macías-Rioseco, M., Silveira, C., Fraga, M., Casaux, L., Cabrera, A., Francia, M. E., Robello, C., Maya, L., Zarantonelli, L., Suanes, A., Colina, R., Buschiazzo, A., Giannitti, F., & Riet-Correa, F. (2020). Causes of abortion in dairy cows in Uruguay. Pesquisa Veterinaria Brasileira, 40(5), 325-332. https://doi.org/10.1590/1678-5150-PVB-6550
Mahmoud, M.A., Mahmoud, N.A., & Allam, A.M. (2009). Investigations on infectious bovine rhinotracheitis in Egyptian cattle and buffaloes. Global Veterinaria, 3(4), 335-340.
Mee, J. F. (2023). Invited review: Bovine abortion—Incidence, risk factors and causes. Reproduction in Domestic Animals, 58(Suppl. 2), 23-33. https://doi.org/10.1111/rda.14366
Ministerio de Ganadería, Agricultura y Pesca. (2023). Anuario estadístico agropecuario. DIEA. https://www.gub.uy/ministerio-ganaderia-agricultura-pesca/comunicacion/publicaciones/anuario-estadistico-agropecuario-2023
Murillo, D. F. B., Negrão Watanabe, T. T., Costa, M. T. D. S., Nakazato, L., & Pescador, C. A. (2024). Bovine abortion caused by leptospirosis. Veterinary Record Case Reports, 12(4), e997. https://doi.org/10.1002/vrc2.997
Musso, D., & La Scola, B. (2013). Laboratory diagnosis of leptospirosis: a challenge. Journal of Microbiology, Immunology and Infection, 46(4), 245-252. https://doi.org/10.1016/j.jmii.2013.03.001
Nettleton, P., & Russell, G. (2017). Update on infectious bovine rhinotracheitis. In Practice, 39(6), 255-272. https://doi.org/10.1136/inp.j2226
Nieves Álvarez, C. J. (2018). Estudios genómicos y moleculares de bacterias del género Leptospira: análisis de la variabilidad genética y contribución en diagnóstico y tipificación [Tesis de maestría, Facultad de Ciencias - PEDECIBA, Universidad de la República]. Colibrí. https://hdl.handle.net/20.500.12008/23242
Organización Mundial de Sanidad Animal. (2021). Leptotospirosis. https://www.woah.org/fileadmin/Home/esp/Health_standards/tahm/3.01.12_Leptospirosis.pdf
Pinto, P. S., Pestana, C., Medeiros, M. A., & Lilenbaum, W. (2017). Plurality of Leptospira strains on slaughtered animals suggest a broader concept of adaptability of leptospires to cattle. Acta Tropica, 172, 156-159. https://doi.org/10.1016/j.actatropica.2017.04.032
Reichel, M.P., Ayanegui-Alcérreca, M.A., Gondim, L.F., & Ellis, J.T. (2013). What is the global economic impact of Neospora caninum in cattle-the billion dollar question. International Journal for Parasitology, 43(2), 133-142.
Reichel, M. P., Wahl, L. C., & Hill, F. I. (2018). Review of diagnostic procedures and approaches to infectious causes of reproductive failures of cattle in Australia and New Zealand. Frontiers in Veterinary Science, 5, 222. https://doi.org/10.3389/fvets.2018.00222
Repiso, M. V., Gil, A., Bañales, P., D’Anatro, N., Fernández, L., Guarino, H., Herrera, B., Núñez, A., Olivera, M., Osawa, M., & Silva, M. (2005). Prevalencia de las principales enfermedades infecciosas que afectan el comportamiento reproductivo en la ganadería de carne y caracterización de los establecimientos de cría del Uruguay. Veterinaria (Montevideo), 40(157), 5-28. https://www.revistasmvu.com.uy/index.php/smvu/article/view/368
Sohm, C., Steiner, J., Jöbstl, J., Wittek, T., Firth, C., Steinparzer, R., & Desvars-Larrive, A. (2023). A systematic review on leptospirosis in cattle: A European perspective. One Health, 17, 100608.
Suanes, A., Macchi, M. V., Fernández, F., Salaberry, X., Moreira, C., & Gil, A. D. (2024). Seroprevalence and herd-level associated factors of pathogenic Leptospira spp. circulating locally in dairy cattle in Uruguay. Preventive Veterinary Medicine, 223, 106097. https://doi.org/10.1016/j.prevetmed.2023.106097
Varni, V., Koval, A., Nagel, A., Ruybal, P., Caimi, K., & Amadio, A. F. (2016). First genome sequence of Leptospira interrogans serovar Pomona, isolated from a bovine abortion. Genome Announcements, 4(3), 10-1128. https://doi.org/10.1128/genomea.00345-16
Zarantonelli, L., Suanes, A., Meny, P., Buroni, F., Nieves, C., Salaberry, X., Briano, C., Ashfield, N., Silveira, C.D.S., Dutra, F., Easton, C., Fraga, M., Giannitti, F., Hamond, C., Macías‑Rioseco, M., Menéndez, C., Mortola, A., Picardeau, M., Quintero, J., … Buschiazzo, A. (2018). Isolation of pathogenic Leptospira strains from naturally infected cattle in Uruguay reveals high serovar diversity, and uncovers a relevant risk for human leptospirosis. PLoS Neglected Tropical Diseases, 12(9), e0006694. https://doi.org/10.1371/journal.pntd.0006694
Nota de contribución
1. Conceptualización, 2. Curación de datos, 3. Análisis formal, 4. Adquisición de fondos, 5. Investigación, 6. Metodología, 7. Administración de proyecto, 8. Escritura-borrador original
Valentina Macchi ha contribuido en 1, 2, 3, 4, 5, 6, 7 y 8. Alejandra Suanes en 1, 4, 5, 6, 7, y 8. Ximena Salaberry en 1, 4, 5, 6 y 8. Bruno Dearmas en 5. Emiliano Rivas en 5. Andrés Gil en 1, 3, 5, 6, y 8.
Disponibilidad de datos
El conjunto de datos que apoya los resultados de este estudio no se encuentra disponible.
Nota del editor
El editor José Manuel Verdes aprobó este artículo.