Veterinaria (Montevideo), 2025 61(224), 10.29155/VET.61.224.3
Artículo original
Relación de variables climáticas con casos de leptospirosis humana: Uruguay, 2010-2023
Relationship between climatic variables and human leptospirosis cases: Uruguay, 2010-2023
Relação entre variáveis climáticas e casos de leptospirose humana: Uruguai, 2010-2023
Lorenzo Verger1, 2 https://orcid.org/0009-0005-1020-7819
Bernabé Vidal3 https://orcid.org/0009-0003-3937-160X
Gustavo J. Nagy3 https://orcid.org/0000-0002-8296-4465
Mario Bidegain4 https://orcid.org/0009-0006-6319-1141
1Unidad de Salud Pública Veterinaria, Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay. Autor para correspondencia: vergerlorenzo@gmail.com
2Unidad de Zoonosis y Vectores, Ministerio de Salud Pública, Montevideo, Uruguay.
3Programa de Posgrado en Ciencias Ambientales, Instituto de Ecología y Ciencias Ambientales (IECA), Facultad de Ciencias, Universidad de la República, Montevideo, Uruguay.
4Asesoría Técnica, Instituto Uruguayo de Meteorología, Montevideo, Uruguay.
Resumen
La leptospirosis es una zoonosis bacteriana de distribución mundial. Es endémica en el Uruguay, donde afecta sobre todo a trabajadores rurales y algunos grupos urbanos. El objetivo de este trabajo fue analizar la relación entre variables climáticas y casos de leptospirosis humana en Uruguay entre los años 2010 y 2023. Se correlacionaron las variables climáticas con los casos mensuales confirmados de leptospirosis en diversos períodos de desfasaje (lag), posteriormente se ajustó un modelo de regresión binomial negativa para analizar el comportamiento del número de casos de leptospirosis en función de variables correlacionadas. Durante el período se detectaron 1218 casos confirmados de leptospirosis. La temperatura media mensual presentó la mayor correlación positiva con los casos del mes siguiente (lag 1) en todo el país. La precipitación acumulada presentó la mayor correlación positiva con la cantidad de casos en lag 1 tanto a nivel nacional como en la zona sur, mientras que en la zona norte la mayor correlación se dio con los casos de dos meses después (lag 2). Los meses con precipitaciones mayores a la media del período y con inundaciones presentaron un número de casos significativamente mayor que los meses con precipitaciones iguales o menores a la media. Según el modelo desarrollado, por cada incremento de 1 °C en la temperatura media mensual, el número de casos del mes siguiente aumenta 8,9 % mientras que, por cada 10 mm de incremento en la precipitación acumulada, el número de casos del mes siguiente aumenta 3,3 %. Se deben fortalecer en especial las acciones de prevención, vigilancia y reconocimiento de la leptospirosis en centros de salud luego de los meses cálidos, con inundaciones o con niveles de precipitación mayor a la media. Estos hallazgos cobran especial relevancia en un contexto de cambio climático, con aumento de las temperaturas medias y frecuencia de fenómenos extremos, como inundaciones.
Palabras clave: Zoonosis, Temperatura, Precipitación, Cambio climático.
Abstract
Leptospirosis is a globally distributed bacterial zoonosis. In Uruguay, it is endemic and primarily affects rural workers and some urban groups. This study aimed to analyze the relationship between climatic variables and human leptospirosis cases in Uruguay from 2010 to 2023. Climatic variables were correlated with monthly confirmed cases of leptospirosis at various lag periods. A negative binomial regression model was then fitted to model the monthly number of cases as a function of the significantly correlated variables. A total of 1218 confirmed cases were reported during the study period. Mean monthly temperature showed the highest positive correlation with cases in the following month (lag 1) nationwide. Accumulated precipitation was most strongly correlated with leptospirosis cases in lag 1 at the national level and in the southern region, while in the north, the strongest correlation was observed at lag 2. Months with above-average precipitation and flooding had significantly more cases than months with average or below-average rainfall. According to the model, each 1 °C increase in mean monthly temperature was associated with a 8.9 % increase in cases the following month, while each 10 mm increase in precipitation was associated with an 3.3 % increase. These findings highlight the need to strengthen prevention, surveillance, and diagnosis of leptospirosis in health centers, particularly after warm, rainy, or flood-prone months. This is especially relevant in the context of climate change, which is increasing average temperatures and the frequency of extreme weather events.
Keywords: Zoonoses, Temperature, Rainfall, Climate change.
Resumo
A leptospirose é uma zoonose bacteriana de distribuição global. No Uruguai, é endêmica e afeta principalmente trabalhadores rurais e alguns grupos urbanos. Este estudo teve como objetivo analisar a relação entre variáveis climáticas e casos humanos de leptospirose no Uruguai entre 2010 e 2023. As variáveis climáticas foram correlacionadas com os casos mensais confirmados de leptospirose em diferentes períodos de defasagem (lag). Um modelo de regressão binomial negativa foi então ajustado para avaliar o número mensal de casos com base nas variáveis significativamente correlacionadas. Um total de 1218 casos confirmados foi registrado durante o período do estudo. A temperatura média mensal apresentou a maior correlação positiva com os casos do mês seguinte (lag 1) em todo o país. A precipitação acumulada teve a correlação mais forte com os casos em lag 1 tanto em nível nacional quanto na região sul, enquanto no norte a maior correlação foi observada em lag 2. Meses com precipitação acima da média e com inundações apresentaram significativamente mais casos do que os meses com precipitação média ou abaixo da média. Segundo o modelo, cada aumento de 1 °C na temperatura média mensal esteve associado a um aumento de 8,9 % nos casos do mês seguinte, enquanto cada aumento de 10 mm na precipitação acumulada foi associado a um aumento de 3,3 %. Esses achados ressaltam a necessidade de reforçar as ações de prevenção, vigilância e diagnóstico da leptospirose nos centros de saúde, especialmente após meses quentes, chuvosos ou com ocorrência de inundações. Isso é particularmente relevante no contexto das mudanças climáticas, que vêm aumentando as temperaturas médias e a frequência de eventos climáticos extremos.
Palavras-chave: Zoonose, Temperatura, Precipitação, Mudança climática.
Fecha de recibido: 07/02/2025
Fecha de aceptado: 24/07/2025
Introducción
La leptospirosis es una zoonosis bacteriana de distribución mundial. La transmisión al ser humano resulta del contacto directo con tejidos de animales infectados o, más comúnmente, con el ambiente contaminado con su orina (Plank & Dean, 2000). La bacteria ingresa al hospedador a través de las mucosas o de lesiones dérmicas, diseminándose por vía sanguínea a la mayoría de los órganos (Ellis, 2014). Resulta especialmente importante para la transmisión de la enfermedad la colonización de los túbulos renales, ya que en esta localización la bacteria puede reproducirse, formar biofilms, evadir el sistema inmune del hospedador y ser liberada al ambiente con la orina (Davignon et al., 2023; Dias & Pinna, 2025). Si bien han sido descriptas otras vías de eliminación, como las descargas uterinas (Ellis, 2014), la leche (De Oliveira et al., 2016) y la materia fecal (Inamasu et al., 2022), el sistema inmune del hospedador suele eliminar con rapidez las leptospiras de la mayoría del organismo, persistiendo la infección principalmente en los riñones (Monahan et al., 2009).
Se han detectado al menos 135 especies de mamíferos susceptibles a la infección por Leptospira (Hagedoorn et al., 2024). Los roedores son los principales reservorios de la enfermedad, pero existen multitud de especies que pueden albergar el patógeno de manera crónica en sus riñones, eliminando por períodos prolongados leptospiras al ambiente a través de la orina (Gomard et al., 2021). Entre estas se encuentran animales domésticos como los bovinos (Monti et al., 2023) y los perros (Sant’Anna da Costa et al., 2021).
La leptospirosis es endémica en nuestro país y ha sido ampliamente estudiada en ecosistemas productivos; solo en bovinos se han aislado y caracterizado más de 40 cepas patógenas de Leptospira spp. (Zarantonelli et al., 2018). En bovinos de leche, se han encontrado seroprevalencias de 27,8 % a nivel poblacional y se estima que un 86,92 % de los rodeos del país presentan al menos un animal seropositivo (Suanes et al., 2024).
Esta enfermedad tiene un considerable impacto en la salud pública, se estima una incidencia anual de 15 casos cada 100 000 personas y afecta sobre todo a jóvenes trabajadores rurales (Schelotto et al., 2012). Sin embargo, la incidencia puede ser alta en algunos grupos urbanos de riesgo, como habitantes de asentamientos o clasificadores de residuos, donde se han encontrado proporciones de seropositivos de 55,5 % y 41,1 % respectivamente (Meny et al., 2019).
La leptospirosis humana es considerada una enfermedad estacional en muchas partes del mundo, asociada a temperaturas elevadas y lluvias, así como a eventos de precipitación extrema e inundaciones (Ercides-Péres et al., 2019). Estudios realizados en nuestro país sugieren que los niveles de precipitación y las inundaciones podrían ser factores que explican la variabilidad en la incidencia de leptospirosis (Schelotto et al., 2012). Asimismo, se han encontrado correlaciones entre el número anual de casos y la precipitación anual acumulada (Nagy et al., 2016b). La emergencia, reemergencia y el aumento de infecciones zoonóticas se relaciona, entre otras causas, al cambio climático (Sánchez et al., 2022; Ternova et al., 2024). Su aumento en años recientes en el Uruguay es, además, estimulado por el calentamiento global; la variabilidad climática asociada al fenómeno ENOS (El Niño-Oscilación Sur), que influye en las variaciones interanuales de las precipitaciones, y los cambios socio-ambientales (Vidal et al., 2024 a; b).
El objetivo de este trabajo fue analizar la relación entre las variables climáticas (temperatura media, precipitación acumulada y humedad relativa media) y los casos de leptospirosis humana en Uruguay entre los años 2010 y 2023.
Materiales y métodos
Se realizó un estudio ecológico durante el período 2010-2023. Se analizaron los datos del país en su conjunto y a su vez divididos en dos regiones: norte —que abarca los departamentos de Artigas, Rivera, Salto, Tacuarembó, Paysandú y Río Negro— y sur —que abarca los departamentos de Colonia, Montevideo, San José, Canelones, Soriano, Flores, Florida, Durazno, Rocha, Maldonado, Lavalleja, Cerro Largo y Treinta y Tres—.
El número de casos humanos confirmados de leptospirosis por mes y departamento se obtuvo de la base de datos del sistema del Departamento de Vigilancia en Salud (Devisa) del Ministerio de Salud Pública (MSP). Esta base de datos registra como casos confirmados de leptospirosis aquellos que presentaron clínica compatible y confirmación de laboratorio (MSP, 2015) mediante las pruebas de aglutinación microscópica (MAT) y/o Elisa. Se realizó la agrupación de los casos totales a nivel país y por zona. Posteriormente se confeccionaron series temporales con una frecuencia mensual, registrando el caso en el mes que correspondiera a la fecha de inicio de síntomas.
Los datos meteorológicos fueron obtenidos mediante solicitud formal al Instituto Uruguayo de Meteorología (Inumet), en el caso de los registros pluviométricos, y del Instituto Nacional de Investigación Agropecuaria (INIA) (INIA, 2023), en el caso de la temperatura y la humedad relativa. Los datos sobre eventos de inundación fueron relevados del Sistema Nacional de Emergencias (Sistema Nacional de Emergencia (SINAE), 2022).
Los datos pluviométricos obtenidos originalmente con frecuencia diaria fueron agrupados según la precipitación acumulada por mes calendario. El Inumet posee estaciones meteorológicas en las 19 capitales departamentales, por lo que se calculó la precipitación acumulada promedio de todas las estaciones meteorológicas del país, de la región norte y de la región sur según la división mencionada antes. Los datos de temperatura media y humedad relativa fueron agrupados según la media mensual a nivel país y separados según región norte (Salto y Tacuarembó) y sur (Colonia, Canelones y Treinta y Tres) de acuerdo con la distribución de las estaciones meteorológicas del INIA.
Se evaluó la relación entre los casos de leptospirosis mensuales y las variables climáticas del mismo mes (lag 0) y de los 4 meses anteriores (lags 1 al 4) considerando que diversos estudios han documentado desfasajes dentro de este rango (Desvars et al., 2011). Esta relación fue evaluada mediante la prueba de correlación de rangos de Spearman, ya que los datos no cumplían el supuesto de normalidad. Se consideraron correlacionadas aquellas variables con p < 0,05 y coeficientes rs > 0,25, umbral adoptado por tratarse de un estudio ecológico con múltiples factores potencialmente intervinientes (Schober et al., 2018).
Se analizó el número de casos de leptospirosis en meses con precipitación igual o inferior a la media del período de estudio, con precipitación superior a la media y con meses de inundaciones. Las diferencias en la mediana de casos para estas categorías fueron evaluadas mediante la prueba U de Mann-Whitney. Los análisis fueron llevados a cabo utilizando el software PAST versión 3.25 (Hammer et al., 2001).
Para analizar el comportamiento de los casos de leptospirosis en función de las variables climáticas, se ajustó un modelo de regresión binomial negativa con función de enlace logarítmica, adecuado para situaciones donde la variable dependiente es un conteo y existe sobredispersión de los datos (Imai et al., 2015) La sobredispersión estimada mediante estadística descriptiva (x̄ ≠ σ²) fue confirmada con la prueba de Cameron y Trivedi (z = 5,77, p < 0,001; dispersión = 4,36) (Cameron & Trivedi, 1990).
La variable dependiente fue el número mensual de casos de leptospirosis a nivel nacional, mientras que las variables predictoras incluyeron aquellas variables climáticas que mostraron correlaciones significativas con el número mensual de casos. Previamente, se evaluó la correlación entre las variables climáticas mediante la prueba de Spearman y se encontró solo entre la humedad relativa y la temperatura (rs = -0,68, p < 0,05). Se evaluó la colinealidad de las variables predictoras mediante el cálculo del factor de inflación de la varianza (VIF). Los valores obtenidos en esta prueba fueron inferiores a 2 para todas las variables predictoras, lo que indica ausencia de colinealidad.
Dado que tanto la humedad relativa como la temperatura tienen fundamentos biológicos como factores que influyen en la supervivencia y proliferación de Leptospira spp., se decidió conservarlas en el modelo. Además de las variables climáticas continuas, se consideró una variable categórica correspondiente al mes del año para controlar por posible estacionalidad. La selección del modelo final se basó en el criterio de información de Akaike (AIC) y en un análisis de sensibilidad, comparando modelos alternativos con y sin determinadas variables.
El modelo se ajustó utilizando la función glm.nb de la biblioteca MASS (Venables & Ripley, 2013) en el software R versión 4.3.2 (R Core Team, 2024). En todos los análisis estadísticos se consideró un nivel de significación de p < 0,05.
Resultados
Durante el período de estudio se detectaron 1218 casos confirmados de leptospirosis. La media anual de casos fue de 87 (DE= 46,6). El año con mayor cantidad de casos acumulados fue el 2014, con 175. La media mensual de casos fue de 7,25 (DE= 5,6), el mes que presentó mayor media de casos fue febrero con 12,3, seguido de marzo con 9,2 y enero con 9 (figura 1).
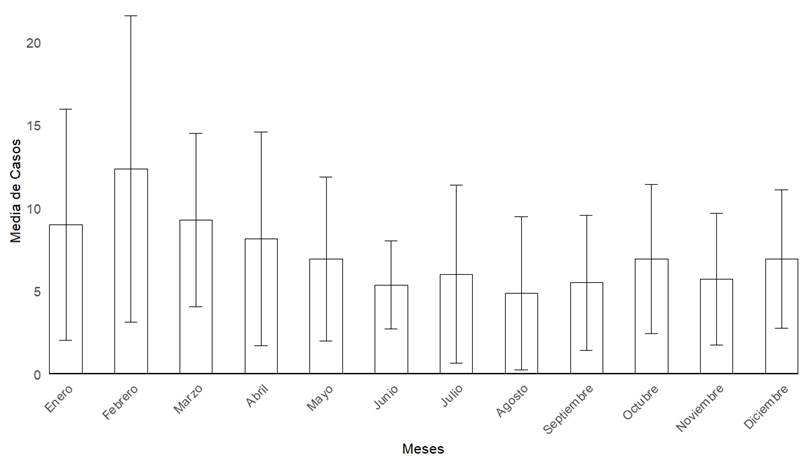
Figura 1. Media de casos de leptospirosis humana por mes (±DE) en todo el país. Período 2010-2023
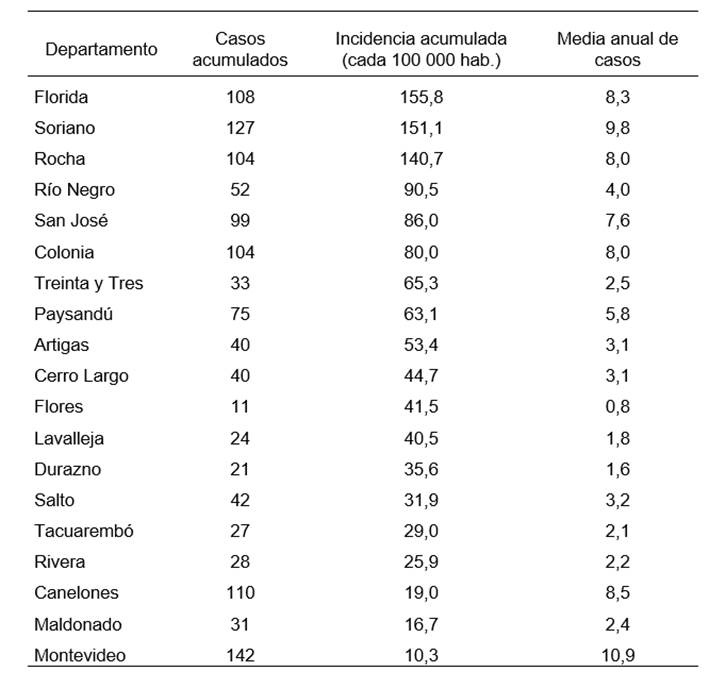
El departamento con mayor cantidad de casos acumulados en el período de estudio fue Montevideo, con 142, mientras que Flores presentó la menor cantidad con 11. El departamento con mayor incidencia acumulada fue Florida, con 155,8 casos cada 100 000 habitantes, mientras que el departamento con menor incidencia acumulada fue Montevideo, con 10,3 casos (tabla 1).
Tabla 1. Casos acumulados, incidencia acumulada y media anual de casos de leptospirosis humana en el período 2010-2023 según departamento, ordenados de forma decreciente según incidencia acumulada
Se elaboraron gráficos de los casos mensuales confirmados de leptospirosis y la precipitación y temperatura a lo largo del período (figuras 2 y 3). La precipitación media acumulada mensual en el período de estudio fue de 108 mm/m2 (DE = 66,6), 100 mm/m2 (DE = 63,7) y 117 mm/m2 (DE = 78,4) para todo el país, región sur y norte respectivamente. Durante el período analizado, la temperatura media mensual fue de 17,7 °C (DE = 4,6), 17,1 °C (DE = 4,6) y 18,6 °C (DE = 4,6) para todo el país, región sur y norte respectivamente. Al desagregar por estación, se registraron promedios de 23,5 °C (DE = 1,0) en verano, 18,1 °C (DE = 3,0) en otoño, 17,2 °C (DE = 2,4) en primavera y 12,1 °C (DE = 1,5) en invierno a nivel nacional.
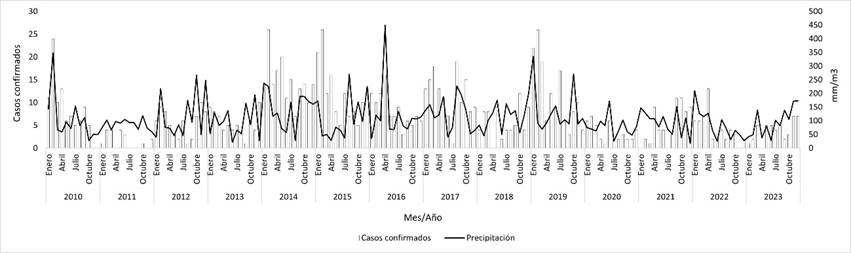
Figura 2. Casos mensuales de leptospirosis humana y precipitación mensual acumulada en todo el país. Período 2010-2023
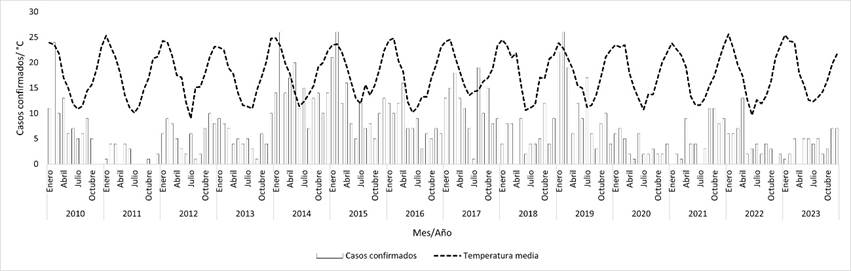
Figura 3. Casos mensuales de leptospirosis humana y temperatura media mensual en todo el país. Período 2010-2023
Se detectaron 10 eventos significativos de inundación en diferentes regiones del Uruguay durante el período de estudio: febrero de 2010, octubre de 2012, noviembre de 2013, diciembre de 2014, diciembre de 2015, abril de 2016, mayo de 2017, enero de 2019, enero de 2021, abril de 2022. La figura 4 muestra cuatro meses con alto exceso de precipitaciones que cubren diferentes regiones del Uruguay. En tres casos (febrero de 2010, abril de 2016 y enero de 2019) se corresponden con eventos El Niño, mientras que octubre de 2012 fue un período neutro.
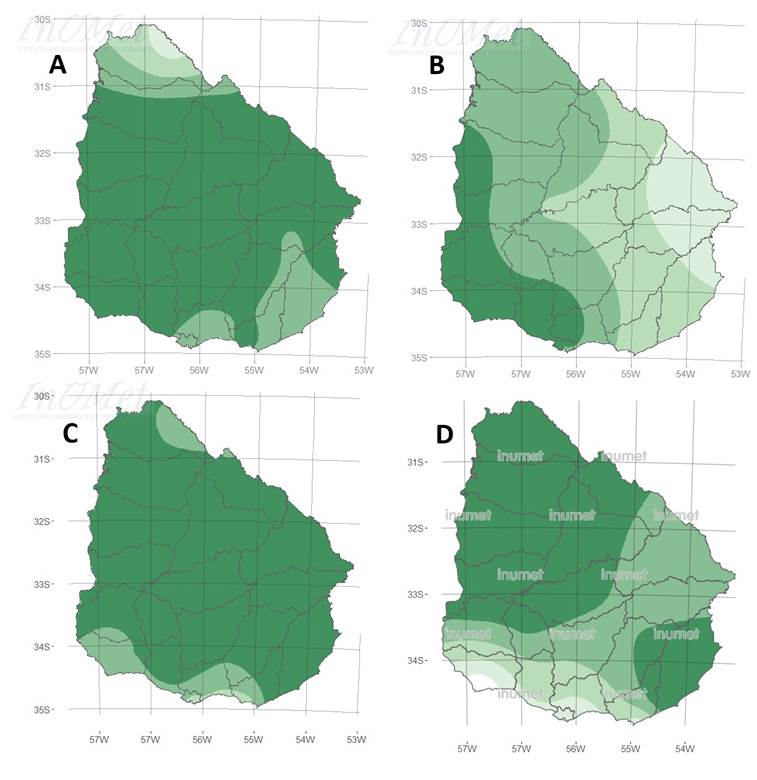
Figura 4. Índice estandarizado de precipitación (IPE) para cuatro eventos con altas precipitaciones (1 mes): febrero 2010 (A), octubre 2012 (B), abril 2016 (C) y enero 2019 (D). El color verde intenso indica mayores precipitaciones. Fuente: Inumet. https://www.inumet.gub.uy/clima/recursos-hidricos/indice-de-precipitacion
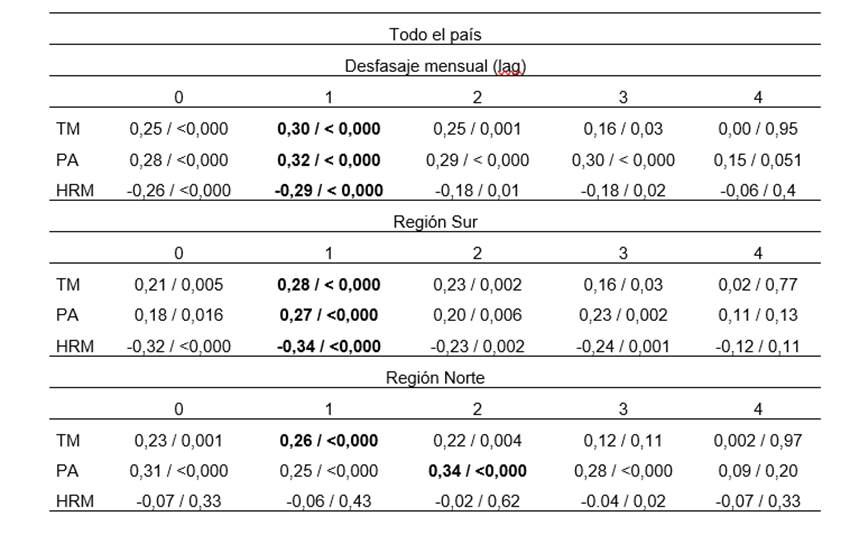
Se observaron correlaciones estadísticamente significativas entre las variables climáticas y el número de casos de leptospirosis en distintos niveles de desfasaje mensual, con una tendencia general a la disminución tanto de la magnitud como de la significancia a medida que aumentaba el lag (tabla 2). A nivel nacional se encontró la mayor correlación positiva y significativa entre el número de casos mensuales de leptospirosis y la precipitación en lag 1 (rs = 0,32, p < 0,0001). En la región sur, los casos mensuales de leptospirosis también estuvieron correlacionados con la precipitación acumulada en lag 1 (rs = 0,27, p < 0,001). En la región norte, la mayor correlación se dio en lag 2 (rs = 0,34, p < 0,00001). Con respecto a la temperatura, los casos mensuales de leptospirosis presentaron la mayor correlación positiva con la temperatura media en lag 1, tanto a nivel nacional (rs = 0,30, p < 0,0001) como en el norte (rs = 0,26, p < 0,001) y el sur (rs = 0,28, p < 0,001). Los casos de leptospirosis presentaron una correlación significativa y negativa con la humedad relativa media en lag 1, tanto a nivel nacional (rs = -0,29, p < 0,001) como en la región sur (rs = -0,38, p < 0,0001). En la región norte, sin embargo, no se encontraron correlaciones significativas en ningún nivel de desfasaje.
Tabla 2. Correlaciones de Spearman (rs / p valor) entre variables climáticas y casos humanos de leptospirosis, considerando desfasajes mensuales (lag 0 a 4). Se presentan los valores para todo el país, región sur y región norte. Las correlaciones más fuertes y estadísticamente significativas se indican en negrita. TM= Temperatura media, PA= Precipitación acumulada, HRM= Humedad relativa media
Se construyó un modelo de regresión binomial negativo incluyendo como variables predictoras del número de casos a nivel nacional la temperatura media mensual, el nivel de precipitación acumulada mensual y la humedad relativa media mensual. Los datos meteorológicos fueron relacionados con los casos del mes siguiente (lag 1) por ser el nivel de desfasaje que presentó la mayor correlación a nivel nacional en todas las variables.
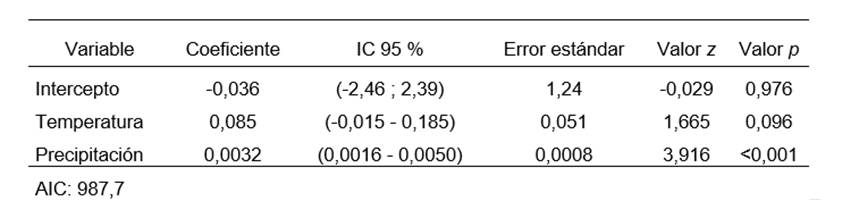
En el primer modelo, la relación de los casos de leptospirosis con la variable humedad relativa no resultó significativa (p > 0,05), lo que sugiere que no contribuye a la explicación de la variabilidad en los casos de leptospirosis. Por este motivo, se eliminó del modelo y se obtuvo una mejora evidenciada por una leve reducción del AIC (988,5 a 987,7).
Para evaluar el efecto conjunto de la temperatura y la precipitación en el número de casos de leptospirosis, se agregó una variable de interacción (temperatura × precipitación). Sin embargo, esta variable de interacción no resultó relevante (p = 0,23) y no mejoró significativamente el modelo, ya que el AIC aumentó de forma leve en lugar de disminuir (987,7 a 989,5). Por lo tanto, se decidió excluir la interacción del modelo final, manteniendo un modelo con mejor ajuste.
Tras la inclusión de la variable mes para ajustar por estacionalidad, ninguno de los coeficientes correspondientes a esta variable resultó significativo (p > 0,05). Sin embargo, los coeficientes estimados para la temperatura y la precipitación mostraron una reducción (temperatura: de 0,124 a 0,085; precipitación: de 0,0083 a 0,0033). El valor p asociado a la temperatura aumentó de 0,026 a 0,096, perdiendo significancia estadística al 5 %. No obstante, eliminar la temperatura del modelo incrementó el AIC (de 987,7 a 988,5), por lo que se decidió conservarla en el modelo final.
El modelo seleccionado incluyó temperatura media mensual y precipitación mensual acumulada, y fue ajustado por estacionalidad mediante la inclusión de la variable mes. Con el objetivo de proporcionar una interpretación práctica de los resultados, los coeficientes obtenidos y sus intervalos de confianza fueron exponenciados y expresados en porcentaje, dado que se utilizó una función de enlace logarítmica. Esta metodología permitió calcular el cambio porcentual esperado en el número de casos de leptospirosis por cada unidad de incremento en las variables independientes, reflejando de manera directa los efectos en la escala original de los datos. Según el modelo obtenido, por cada 1 °C de aumento en la temperatura media mensual, el número de casos de leptospirosis en el mes siguiente aumenta un 8,9 % (IC 95 %: –0,6 % a 18,9 %), aunque esta asociación no fue estadísticamente significativa cuando se ajustó por estacionalidad. En cambio, por cada 10 mm de aumento en la precipitación acumulada, los casos aumentaron un 3,3 % (IC 95 %: 1,6 %–6,1 %), con una asociación significativa (tabla 3).
Tabla 3. Resultados del modelo binomial negativo seleccionado. Las variables climáticas (temperatura y precipitación) se relacionaron con los casos del mes siguiente (lag 1). El modelo fue ajustado por estacionalidad mediante la variable categórica mes.
La mediana de casos de leptospirosis en los meses con precipitación superior a la media fue significativamente mayor que la de los casos de meses con precipitación igual o menor a la media del período (U = 2045, p = 0,0001). Los meses con inundaciones también presentaron un número de casos significativamente mayor a los meses con precipitaciones iguales o menores a la media del período (U = 232, p = 0,003). Asimismo, la mediana de casos en meses en los que ocurrieron inundaciones fue superior a la de los meses con precipitaciones por encima de la media, aunque esta diferencia no resultó significativa (U = 240,5, p = 0,19) (figura 5).
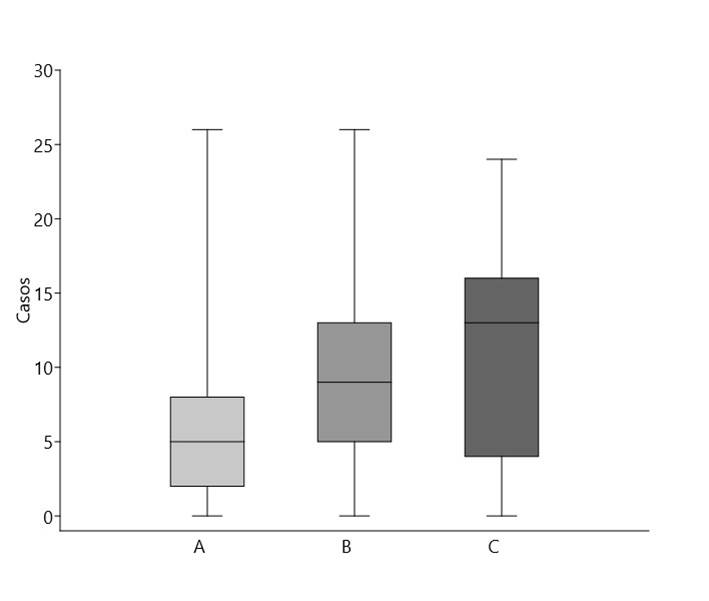
Figura 5. Distribución de casos de leptospirosis humana en el período 2010-2023, agrupados según meses con precipitación igual o menor a la media (A), mayor a la media (B) y en meses con inundaciones (C)
Discusión
En este este trabajo se exploró mediante un estudio ecológico la relación entre las variables climáticas y los casos de leptospirosis humana. Las variables que presentan la mayor correlación con los casos mensuales de leptospirosis humana son la temperatura media y la precipitación acumulada.
Los factores ambientales desempeñan un rol determinante en la ecología de las especies patógenas del género Leptospira. Aunque por lo general estas bacterias no se replican fuera del hospedador (Casanovas-Massana et al., 2018), pueden sobrevivir y mantenerse infectantes durante meses en suelos húmedos y cuerpos de agua, especialmente a temperaturas en el entorno de 30 °C (Andre-Fontaine et al., 2015; Bierque et al., 2020).
Si bien el suelo seco es un ambiente hostil para la supervivencia de Leptospira spp., la bacteria puede sobrevivir en suelos húmedos regulando su profundidad según la disponibilidad de oxígeno y formando biofilms para retener agua. Las lluvias e inundaciones facilitarían su liberación y dispersión (Davignon et al., 2023).
La mayor ocurrencia de leptospirosis en períodos de altas temperaturas ha sido detectada en estudios en Sudamérica (López et al., 2019; Montenegro-Idrogo et al., 2024; Silva et al., 2020). Por ejemplo, un estudio sobre las características clínico-epidemiológicas de los casos de leptospirosis en Argentina entre 1999 y 2005 determinó que el 76 % de los casos se presentaron en el período que va desde mediados del verano hasta el fin del otoño (Vanasco et al., 2008). Otros estudios, principalmente en regiones tropicales donde la variación anual de temperatura es menor, encontraron correlaciones negativas o no significativas (Chery et al., 2020; Coelho & Massad, 2012; Gutierrez, 2021).
La temperatura es un factor crítico en la ecología de los roedores reservorios, ya que favorece la actividad reproductiva y aumenta la disponibilidad de alimento. Estudios realizados en diversas especies de roedores sinantrópicos y silvestres sugieren que la temperatura es uno de los factores que disminuyen la estacionalidad reproductiva y permiten un mayor número de camadas en el año (Heldstab, 2021). Además, en las zonas templadas, los picos de actividad de roedores se dan usualmente en los meses de verano y otoño (Boiani et al., 2008; Tamayo et al., 2013; Vadell et al., 2010). Del mismo modo, la temperatura elevada dentro de los rangos detectados en este estudio aumenta el tiempo de supervivencia de las leptospiras en el agua (Andre-Fontaine et al., 2015).
Otro posible efecto de las altas temperaturas es el aumento de la exposición humana, ya que las personas tienden a buscar refrescarse en cuerpos de agua dulce que podrían estar contaminados con leptospiras, además de incrementarse la frecuencia de actividades recreativas en estos entornos (Baharom et al., 2024).
El aumento de casos de leptospirosis asociado al aumento de precipitaciones y el mayor riesgo a enfermar en períodos de inundación ha sido observado en nuestra región y el mundo (Ghizzo Filho et al., 2018; López et al., 2019; Pappas et al., 2008; Soni et al., 2024). Existen diversas explicaciones posibles para estos hallazgos; en áreas urbanas, las lluvias intensas frecuentemente colapsan los sistemas de alcantarillado, esto aumenta las áreas inundadas, incrementa las probabilidades de contacto con aguas contaminadas o roedores y propicia la supervivencia de la bacteria en el ambiente.
En ambientes rurales existe una mayor cantidad de animales peridomésticos y sinantrópicos que podrían eliminar leptospiras a un ambiente favorable por las altas condiciones de humedad generadas por las lluvias (Barragan et al., 2017). Las lluvias generan suelos húmedos y aumentan el caudal y cantidad de cursos de agua, facilitando así la supervivencia de las leptospiras, que pueden permanecer infectantes por al menos 43 días en el suelo húmedo (Smith & Self, 1955) y 20 meses en el agua dulce (Andre-Fontaine et al., 2015).
A nivel país y en la región sur, la mayor correlación de los casos de leptospirosis con la precipitación se detectó en lag 1. Estudios realizados en Colombia (Gutierrez, 2021), Filipinas (Matsushita et al., 2018) y Brasil (Guimarães et al., 2014) detectaron relaciones entre las precipitaciones y los casos de leptospirosis con lags de entre 1 y 4 semanas. En línea con estos hallazgos, el lag de 1 mes detectado en este estudio puede ser explicado por el tiempo que transcurre entre el aumento del riesgo que producen las lluvias, la exposición y el período de incubación de la enfermedad (2-30 días) (Vijayachari et al., 2008).
En la región norte, los coeficientes de correlación fueron mayores en lag 2. Una posible explicación es la existencia de distintos tipos de exposición al patógeno (laboral, en hogares o en aguas recreativas) con respecto a la región sur. En este caso, es esperable que la lluvia tenga una influencia más inmediata en la transmisión por roedores en el entorno doméstico y por baños recreativos que en la transmisión ocupacional, donde la infección está determinada mayormente por el contacto con especies productivas infectadas previamente (Matsushita et al., 2018). Sin embargo, en este estudio no se contó con datos de posibles sitios de exposición de los casos, por lo que esta hipótesis podrá ser evaluada en investigaciones futuras.
Luego de ajustar por estacionalidad el modelo utilizado en este estudio, los coeficientes de la precipitación y la temperatura se redujeron y la variable temperatura perdió significancia estadística. Esto sugiere que parte de la variabilidad estacional en los casos de leptospirosis podría explicarse por patrones estacionales distintos a los factores climáticos analizados (cambio en las actividades humanas, ciclos reproductivos de los reservorios, prácticas agrícolas). Este fenómeno se ha observado en estudios similares sobre leptospirosis y otras enfermedades sensibles al clima (Lau et al., 2010; Wasinski & Dutkiewicz, 2013).
El presente trabajo detectó una mayor cantidad de casos de leptospirosis en meses con precipitaciones superiores a la media y en meses con inundaciones. Las inundaciones pueden generar un aumento del contacto de las personas con aguas contaminadas, desplazamiento y concentración de roedores y seres humanos en las áreas secas, dispersión de las leptospiras en el suelo y condiciones higiénicas deficientes. Una revisión sistemática del tema sugiere que aproximadamente un 23 % de los brotes de leptospirosis a nivel mundial entre 1970 y 2012 podrían haber sido causados por la exposición al agua durante las inundaciones y eventos extremos (Munoz-Zanzi et al., 2020).
La correlación negativa entre los casos de leptospirosis y la humedad relativa podría deberse a la correlación detectada entre la humedad relativa y la temperatura. A medida que la temperatura aumenta, la humedad relativa disminuye (Bencloski, 1982). Por lo tanto, el aumento de los casos de leptospirosis se relacionaría con el aumento de la temperatura, mientras que la humedad relativa no mejora el ajuste del modelo binomial negativo utilizado.
El incremento de casos de leptospirosis asociado al aumento de temperatura y precipitación detectado en este trabajo resulta especialmente relevante en el contexto actual y futuro de cambio climático. En nuestro país se ha detectado un incremento de 0,8 °C en la temperatura anual media en el período 1901-2000. Asimismo, se ha detectado una tendencia creciente en los niveles de precipitación intensa al menos desde 1950. Los escenarios de cambio climático futuro (2050) proyectan para el Uruguay un aumento en las temperaturas medias (+ 1,5 a + 3 °C), veranos más largos y calurosos, un incremento de eventos climáticos extremos, entre los que se encuentran las inundaciones y un cambio sustancial en los regímenes de precipitaciones (Aznarez et al., 2021; Bidegain et al., 2012; 2017; Intergovernmental Panel on Climate Change (IPCC), 2021; Nagy et al., 2016a).
Estas condiciones proyectadas son especialmente favorables para la supervivencia y transmisión de Leptospira spp., que prospera en ambientes cálidos y húmedos. La bacteria sobrevive mejor a temperaturas entre 28 y 30 °C, en cuerpos de agua y en suelos con un contenido de agua mayor al 30 % (Bierque et al., 2020; Saito et al., 2013).
Este trabajo presenta algunas limitaciones. El número de casos de leptospirosis en algunos departamentos es muy escaso, lo que dificulta un análisis con mayor resolución espacial, es posible que el efecto observado en este estudio sea mayor o menor dependiendo de la región. Este estudio no diferenció entre casos rurales y urbanos o suburbanos, por lo que pueden existir importantes diferencias en los factores que faciliten la infección en distintos grupos humanos expuestos. En este estudio se analizaron solo los casos confirmados de la enfermedad, ya que no se contaba con información del número de sospechas. Típicamente, la leptospirosis presenta un importante subdiagnóstico (Cassadou et al., 2016; Ellis et al., 2008; Pinto et al., 2022). Es posible que una situación similar ocurra en Uruguay, donde la presencia de otras enfermedades febriles y la baja sospecha clínica podrían estar contribuyendo a una subestimación de la verdadera carga de leptospirosis. Por lo tanto, los datos disponibles podrían no reflejar completamente el número real de casos ni la magnitud del impacto de los factores climáticos asociados.
Conclusiones
El incremento en la precipitación acumulada mensual y la temperatura media mensual están asociadas al aumento del número de casos humanos de leptospirosis a nivel nacional. Este efecto se observa mayormente en el número de casos del mes siguiente. Asimismo, las precipitaciones por encima de la media y las inundaciones tienen un papel importante en favorecer la transmisión de la enfermedad. Estos hallazgos cobran especial relevancia en un contexto de cambio climático con aumento de las temperaturas medias, mayor frecuencia de eventos ENOS y de fenómenos extremos como inundaciones. A nivel de salud pública, se sugiere fortalecer las acciones de prevención y comunicación de la enfermedad, así como estimular la vigilancia y reconocimiento de la leptospirosis en centros de salud, luego de los meses cálidos, con inundaciones o con niveles de precipitación mayor a la media.
Agradecimientos
Al Dr. Gustavo Gagliano por su asesoramiento y aportes a la planificación de este trabajo.
Referencias
Andre-Fontaine, G., Aviat, F., & Thorin, C. (2015). Waterborne leptospirosis: survival and preservation of the virulence of pathogenic Leptospira spp. in fresh water. Current Microbiology, 71, 136-142.
Aznarez, C., Jimeno-Sáez, P., López-Ballesteros, A., Pacheco, J. P., & Senent-Aparicio, J. (2021). Analysing the impact of climate change on hydrological ecosystem services in Laguna del Sauce (Uruguay) using the SWAT model and remote sensing data. Remote Sensing, 13(10), 2014.
Baharom, M., Ahmad, N., Hod, R., Ja’afar, M. H., Arsad, F. S., Tangang, F., Ali, N., & Osman, Y. (2024). Environmental and occupational factors associated with leptospirosis: A systematic review. Heliyon, 10(1), e23473.
Barragan, V., Olivas, S., Keim, P., & Pearson, T. (2017). Critical knowledge gaps in our understanding of environmental cycling and transmission of Leptospira spp. Applied and Environmental Microbiology, 83(19), e01190-17. https://doi.org/10.1128/AEM.01190-17
Bencloski, J. W. (1982). Air temperature and relative humidity: A simulation. Journal of Geography, 81(2), 64-65. https://doi.org/10.1080/00221348208980713
Bidegain, M., Crisci, C., Del Puerto, L., Inda, H., Mazzeo, N., Taks, J., & Terra, R. (2012). Clima de cambios: nuevos desafíos de adaptación en Uruguay: Vol. 1. Variabilidad climática de importancia para el sector productivo. FAO, MGAP. http://www.fao.org/docrep/field/009/as253s/as253s.pdf
Bidegain, M., Pasten, M., Nagy, G. J., Coronel, G., Ferrer, J., & Arana, I. (2017). Tendencias recientes de las precipitaciones e impactos asociados con ENSO en la cuenca del Río de la Plata. Paraquaria Natural, 5(2), 8-18.
Bierque, E., Thibeaux, R., Girault, D., Soupé-Gilbert, M. E., & Goarant, C. (2020). A systematic review of Leptospira in water and soil environments. PloS one, 15(1), e0227055. https://doi.org/10.1371/journal.pone.0227055
Boiani, L., Berois, N., & D’Elía, G. (2008). Annual male reproductive cycle of a Hantavirus reservoir, the long-tailed mouse Oligoryzomys flavescens (Rodentia; Cricetidae, Sigmodontinae) from Uruguay. Mastozoología Neotropical, 15(1), 23-32.
Cameron, A. C., & Trivedi, P. K. (1990). Regression-based tests for overdispersion in the Poisson model. Journal of Econometrics, 46(3), 347-364. https://doi.org/10.1016/0304-4076(90)90014-K
Casanovas-Massana, A., Pedra, G. G., Wunder Jr, E. A., Diggle, P. J., Begon, M., & Ko, A. I. (2018). Quantification of Leptospira interrogans survival in soil and water microcosms. Applied and Environmental Microbiology, 84(13), e00507-18. https://doi.org/10.1128/AEM.00507-18
Cassadou, S., Rosine, J., Flamand, C., Escher, M., Ledrans, M., Bourhy, P., Leparc-Goffart, I., & Quénel, P. (2016). Underestimation of leptospirosis incidence in the French West Indies. PLoS Neglected Tropical Diseases, 10(4), e0004668. https://doi.org/10.1371/journal.pntd.0004668
Chery, G., Francis, L., Hunte, S. A., & Leon, P. (2020). Epidemiology of human leptospirosis in Saint Lucia, 2010–2017. Revista Panamericana de Salud Pública, 44, e160. https://doi.org/10.26633/RPSP.2020.160
Coelho, M. S., & Massad, E. (2012). The impact of climate on Leptospirosis in São Paulo, Brazil. International Journal of Biometeorology, 56, 233-241. https://doi.org/10.1007/s00484-011-0419-4
Davignon, G., Cagliero, J., Guentas, L., Bierque, E., Genthon, P., Gunkel-Grillon, P., Vernel-Pauillac, F., & Goarant, C. (2023). Leptospirosis: toward a better understanding of the environmental lifestyle of Leptospira. Frontiers in Water, 5, 1195094. https://doi.org/10.3389/frwa.2023.1195094
De Oliveira, D., Figueira, C. P., Zhan, L., Pertile, A. C., Pedra, G. G., Gusmão, I. M., Carvalho-Costa, F. A., & Costa, F. (2016). Leptospira in breast tissue and milk of urban Norway rats (Rattus norvegicus). Epidemiology & Infection, 144(11), 2420-2429. https://doi.org/10.1017/S0950268816000637
Desvars, A., Cardinale, E., & Michault, A. (2011). Seasonality of human leptospirosis in Reunion Island (Indian Ocean) and its association with meteorological data. Epidemiology and Infection, 139(6), 837-846. https://doi.org/10.1371/journal.pone.0020377
Dias, C. S., & Pinna, M. H. (2025). Leptospira biofilms: implications for survival, transmission, and disease management. Applied and Environmental Microbiology, 91(2), e01914-24. https://doi.org/10.1128/aem.01914-24
Ellis, T., Imrie, A., Katz, A. R., & Effler, P. V. (2008). Underrecognition of leptospirosis during a dengue fever outbreak in Hawaii, 2001–2002. Vector-Borne and Zoonotic Diseases, 8(4), 541-548. https://doi.org/10.1089/vbz.2007.0241
Ellis, W. A. (2014). Animal leptospirosis. En B. Adler (Ed.), Leptospira and leptospirosis (pp. 99-137). Springer. https://doi.org/10.1007/978-3-662-45059-8_6
Ercides Péres, W., Russo, A., & Nunes, B. (2019). The association between hydro-meteorological events and leptospirosis hospitalizations in Santa Catarina, Brazil. Water, 11(5), 1052. https://doi.org/10.3390/w11051052
Ghizzo Filho, J., Nazário, N. O., Freitas, P. F., Pinto, G. D. A., & Schlindwein, A. D. (2018). Temporal analysis of the relationship between leptospirosis, rainfall levels and seasonality, Santa Catarina, Brazil, 2005-2015. Revista do Instituto de Medicina Tropical de São Paulo, 60, e39. https://doi.org/10.1590/S1678-9946201860039
Gomard, Y., Dellagi, K., Goodman, S. M., Mavingui, P., & Tortosa, P. (2021). Tracking animal reservoirs of pathogenic Leptospira: The right test for the right claim. Tropical Medicine and Infectious Disease, 6(4), 205. https://doi.org/10.3390/tropicalmed6040205
Guimarães, R. M., Cruz, O. G., Parreira, V. G., Mazoto, M. L., Vieira, J. D., & Asmus, C. I. R. F. (2014). Temporal analysis of the relationship between leptospirosis and the occurrence of flooding due to rainfall in the city of Rio de Janeiro, Brazil, 2007-2012. Ciencia & Saude Coletiva, 19(9), 3683-3692. https://doi.org/10.1590/1413-81232014199.06432014
Gutierrez, J. D. (2021). Effects of meteorological factors on human leptospirosis in Colombia. International Journal of Biometeorology, 65(2), 257-263. https://doi.org/10.1007/s00484-020-02028-2
Hagedoorn, N. N., Maze, M. J., Carugati, M., Cash-Goldwasser, S., Allan, K. J., Chen, K., Cossic, B., Demeter, E., Gallagher, S., German, R., Galloway, R. L., Habuš, J., Rubach, M. P., Shiokawa, K., Sulikhan, N., & Crump, J. A. (2024). Global distribution of Leptospira serovar isolations and detections from animal host species: A systematic review and online database. Tropical Medicine & International Health, 29(3), 161-172. https://doi.org/10.1111/tmi.13965
Hammer, Ø., Harper, D. A. T., & Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 4(1), 4. https://doc.rero.ch/record/15326/files/PAL_E2660.pdf
Heldstab, S. A. (2021). Latitude, life history and sexual size dimorphism correlate with reproductive seasonality in rodents. Mammal Review, 51(2), 256-271. https://doi.org/10.1111/mam.12231
Imai, C., Armstrong, B., Chalabi, Z., Mangtani, P., & Hashizume, M. (2015). Time series regression model for infectious disease and weather. Environmental Research, 142, 319-327. https://doi.org/10.1016/j.envres.2015.06.040
Inamasu, Y., Nikaido, Y., Miyahara, S., Maruoka, T., Takigawa, T., Ogawa, M., Sato, M., & Saito, M. (2022). Dissemination of Leptospira into the intestinal tract resulting in fecal excretion in a hamster model of subcutaneous infection with Leptospira interrogans. Microbial Pathogenesis, 165, 105481. https://doi.org/10.1016/j.micpath.2022.105481
Instituto Nacional de Investigación Agropecuaria. (2024). Banco de datos agroclimático. https://www.inia.uy/gras/Clima/Banco-datos-agroclimatico
Intergovernmental Panel on Climate Change. (2021). Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press. https://doi.org/10.1017/9781009157896
Lau, C. L., Smythe, L. D., Craig, S. B., & Weinstein, P. (2010). Climate change, flooding, urbanisation and leptospirosis: fuelling the fire? Transactions of the Royal Society of Tropical Medicine and Hygiene, 104(10), 631-638. https://doi.org/10.1016/j.trstmh.2010.07.002
López, M. S., Müller, G. V., Lovino, M. A., Gómez, A. A., Sione, W. F., & Pomares, L. A. (2019). Spatio-temporal analysis of leptospirosis incidence and its relationship with hydroclimatic indicators in northeastern Argentina. Science of the Total Environment, 694, 133651. https://doi.org/10.1016/j.scitotenv.2019.133651
Matsushita, N., Ng, C. F. S., Kim, Y., Suzuki, M., Saito, N., Ariyoshi, K., Koizumi, N., & Hashizume, M. (2018). The non-linear and lagged short-term relationship between rainfall and leptospirosis and the intermediate role of floods in the Philippines. PLoS Neglected Tropical Diseases, 12(4), e0006331. https://doi.org/10.1371/journal.pntd.0006331
Meny, P., Menéndez, C., Ashfield, N., Quintero, J., Rios, C., Iglesias, T., Vignolo, L., & Varela, G. (2019). Seroprevalence of leptospirosis in human groups at risk due to environmental, labor or social conditions. Revista Argentina de Microbiología, 51(4), 324-333. https://doi.org/10.1016/j.ram.2019.01.005
Ministerio de Salud Pública. (2015). Guía Nacional de Vigilancia y Control de Enfermedades y Eventos Sanitarios de Notificación Obligatoria. https://www.gub.uy/ministerio-salud-publica/comunicacion/publicaciones/guia-nacional-vigilancia-control-enfermedades-eventos-sanitarios
Monahan, A. M., Callanan, J. J., & Nally, J. E. (2009). Host-pathogen interactions in the kidney during chronic leptospirosis. Veterinary Pathology, 46(5), 792-799. https://doi.org/10.1354/vp.08-VP-0265-N-REV
Montenegro-Idrogo, J. J., Bonilla-Aldana, D. K., & Rodríguez-Morales, A. J. (2024). Risk of human leptospirosis in Colombia: spatiotemporal analysis and related hydroclimatic factors. Transactions of The Royal Society of Tropical Medicine and Hygiene, 18(9), 605-615. https://doi.org/10.1093/trstmh/trae013
Monti, G., Montes, V., Tortosa, P., Tejeda, C., & Salgado, M. (2023). Urine shedding patterns of pathogenic Leptospira spp. in dairy cows. Veterinary Research, 54(1), 64. https://doi.org/10.1186/s13567-023-01190-w
Munoz-Zanzi, C., Groene, E., Morawski, B. M., Bonner, K., Costa, F., Bertherat, E., & Schneider, M. C. (2020). A systematic literature review of leptospirosis outbreaks worldwide, 1970-2012. Revista Panamericana de Salud Pública, 44, e78. https://doi.org/10.26633/RPSP.2020.78
Nagy, G.J., Bidegain, M., Verocai, J., & de los Santos, B. (2016a). Escenarios climáticos futuros sobre Uruguay. Basados en los nuevos escenarios socioeconómicos RCP (Project Report PNUD URU/11/G31). Climate Change Division; MVOTMA.
Nagy, G. J., Coronel, G., Pastén, M., Báez, J., Monte-Domecq, R., Galeano-Rojas, A., Cabrera, S., & Arana, I. (2016b). Impacts on well-being and health by excessive rainfall and floods in Paraguay, Uruguay and Bolivia. En W. Leal, U. M. Azeiteiro & F. Alves (Eds.), Climate Change and Health (pp. 475-514). Springer. https://doi.org/10.1007/978-3-319-24660-4_27
Pappas, G., Papadimitriou, P., Siozopoulou, V., Christou, L., & Akritidis, N. (2008). The globalization of leptospirosis: worldwide incidence trends. International Journal of Infectious Diseases, 12(4), 351-357. https://doi.org/10.1016/j.ijid.2007.09.011
Pinto, G. V., Senthilkumar, K., Rai, P., Kabekkodu, S. P., Karunasagar, I., & Kumar, B. K. (2022). Current methods for the diagnosis of leptospirosis: Issues and challenges. Journal of Microbiological Methods, 195, 106438. https://doi.org/10.1016/j.mimet.2022.106438
Plank, R., & Dean, D. (2000). Overview of the epidemiology, microbiology, and pathogenesis of Leptospira spp. in humans. Microbes and Infection, 2(10), 1265-1276. https://doi.org/10.1016/S1286-4579(00)01280-6
R Core Team. (2024). R: A language and environment for statistical computing. R Foundation for Statistical Computing. https://www.R-project.org/
Saito, M., Villanueva, S. Y. A. M., Chakraborty, A., Miyahara, S., Segawa, T., Asoh, T., Ozuru, R., Gloriani, N. G., Yanagihara, Y., & Yoshida, S. (2013). Comparative analysis of Leptospira strains isolated from environmental soil and water in the Philippines and Japan. Applied and Environmental Microbiology, 79(2), 601-609. https://doi.org/10.1128/AEM.02728-12
Sánchez, A., Contreras, A., Corrales, J. C., & de la Fe, C. (2022). In the beginning it was zoonosis: One Health to combat this and future pandemics. SESPAS Report 2022. Gaceta Sanitaria, 36 (Suppl.), S61-S67. https://doi.org/10.1016/j.gaceta.2022.01.012
Sant’Anna da Costa, R., N., Di Azevedo, M. I., dos Santos Baptista Borges, A. L., Carvalho-Costa, F. A., Martins, G., & Lilenbaum, W. (2021). Persistent high leptospiral shedding by asymptomatic dogs in endemic areas triggers a serious public health concern. Animals, 11(4), 937. https://doi.org/10.3390/ani11040937
Schelotto, F., Hernández, E., González, S., Del Monte, A., Ifran, S., Flores, K., Pardo, L., Parada, D., Filippini, M., Balseiro, V., Geymonat, J. P., & Varela, G. (2012). A ten-year follow-up of human leptospirosis in Uruguay: an unresolved health problem. Revista do Instituto de Medicina Tropical de São Paulo, 54, 69-76. https://doi.org/10.1590/s0036-46652012000200003
Schober, P., Boer, C., & Schwarte, L. A. (2018). Correlation coefficients: appropriate use and interpretation. Anesthesia & analgesia, 126(5), 1763-1768. https://doi.org/10.1213/ANE.0000000000002864
Silva, A. E. P., Conceição, G. M. D. S., & Chiaravalloti Neto, F. (2020). Spatial analysis and factors associated with leptospirosis in Santa Catarina, Brazil, 2001-2015. Revista da Sociedade Brasileira de Medicina Tropical, 53, e20200466. https://doi.org/10.1590/0037-8682-0466-2020
Sistema Nacional de Emergencia. (2022). Inundaciones. https://www.gub.uy/sistema-nacional-emergencias/inundaciones
Smith, D. J. W., & Self, H. R. M. (1955). Observations on the survival of Leptospira australis A in soil and water. Epidemiology & Infection, 53(4), 436-444. https://doi.org/10.1017/S0022172400000942
Soni, N., Eyre, M. T., Souza, F. N., Diggle, P. J., Ko, A. I., Begon, M., Childs, J. E., & Costa, F. (2024). Disentangling the influence of reservoir abundance and pathogen shedding on zoonotic spillover of the Leptospira agent in urban informal settlements. Frontiers in Public Health, 12, 1447592. https://doi.org/10.3389/fpubh.2024.1447592
Suanes, A., Macchi, M. V., Fernández, F., Salaberry, X., Moreira, C., & Gil, A. D. (2024). Seroprevalence and herd-level associated factors of pathogenic Leptospira spp. circulating locally in dairy cattle in Uruguay. Preventive Veterinary Medicine, 223, 106097. https://doi.org/10.1016/j.prevetmed.2023.106097
Tamayo, I., Mahiques, J., & Mughini, L. (2013). Temporal distribution and weather correlates of Norway rat (Rattus norvegicus) infestations in the city of Madrid, Spain. EcoHealth, 10, 137-144. https://doi.org/10.1007/s10393-013-0829-3
Ternova, L., Verger, L., & Nagy, G. J. (2024). Reviewing Planetary Health in light of Research Directions in One Health. Research Directions: One Health, 2, e7. https://doi.org/10.1017/one.2024.3
Vadell, M. V., Cavia, R., & Suarez, O. V. (2010). Abundance, age structure and reproductive patterns of Rattus norvegicus and Mus musculus in two areas of the city of Buenos Aires. International Journal of Pest Management, 56(4), 327-336. https://doi.org/10.1080/09670874.2010.499479
Vanasco, N. B., Schmeling, M. F., Lottersberger, J., Costa, F., Ko, A. I., & Tarabla, H. D. (2008). Clinical characteristics and risk factors of human leptospirosis in Argentina (1999–2005). Acta Tropica, 107(3), 255-258. https://doi.org/10.1016/j.actatropica.2008.06.007
Venables, W. N., & Ripley, B. D. (2013). Modern applied statistics with S-PLUS. Springer Science & Business Media.
Vidal, B., Verger, L., & Nagy, G.J. (2024a). Emergent and re-emergent zoonotic infectious diseases in Uruguay (2004-2024) and socio-environmental changes. A one health perspective. MedCrave Online Journal of Public Health, 13(3),154-159.
Vidal, B., Verger, L., & Nagy, G.J. (2024b). Emergent and re-emergent zoonotic infectious diseases in Uruguay (2004-2024). Part II: Arboviral diseases. MedCrave Online Journal of Public Health, 13(3),178‒185.
Vijayachari, P., Sugunan, A. P., & Shriram, A. N. (2008). Leptospirosis: an emerging global public health problem. Journal of Biosciences, 33(4), 557-569. https://doi.org/10.1007/s12038-008-0074-z
Wasinski, B., & Dutkiewicz, J. (2013). Leptospirosis-current risk factors connected with human activity and the environment. Annals of Agricultural and Environmental Medicine, 20(2), 239-244.
Zarantonelli, L., Suanes, A., Meny, P., Buroni, F., Nieves, C., Salaberry, X., Laborde, J., & Grupo de Trabajo Interinstitucional de Leptospirosis Consortium. (2018). Isolation of pathogenic Leptospira strains from naturally infected cattle in Uruguay reveals high serovar diversity, and uncovers a relevant risk for human leptospirosis. PLoS Neglected Tropical Diseases, 12(9), e0006694. https://doi.org/10.1371/journal.pntd.0006694
Nota de contribución
1. Conceptualización, 2. Curación de los datos, 3. Análisis formal, 4. Supervisión, 5. Redacción-borrador original, 6. Redacción-revisión y edición.
Lorenzo Verger ha contribuido en 1, 2, 3, 4, 5. Bernabé Vidal en 1, 6. Gustavo Nagy en 1, 4, 6. Mario Bidegain en 2, 6.
Declaración de uso de inteligencia artificial
Los autores utilizaron la herramienta Chat GPT (versión GPT-4) para la corrección gramatical y la mejora en la claridad de los textos. Asimismo, se utilizó esta herramienta para la corrección y ajuste de los scripts utilizados en R para la realización de los análisis estadísticos.
Disponibilidad de datos
Los datos epidemiológicos utilizados en este estudio pueden obtenerse a través de una solicitud de acceso a la información pública dirigida al MSP. Los datos meteorológicos están disponibles previa solicitud al Inumet y libre acceso a través del Banco de Datos Agroclimáticos del INIA.
Nota del editor
El editor José Manuel Verdes aprobó este artículo.